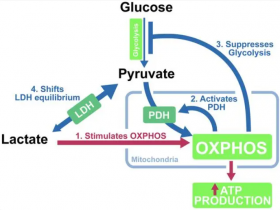
乳酸脱氢酶(LDH或LD)是参与糖酵解和糖异生工程中催化乳酸和丙酮酸之间氧化还原反应的重要酶类。它可逆地催化下述反应:
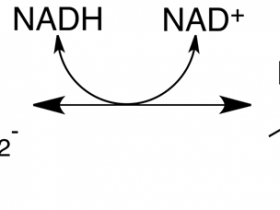
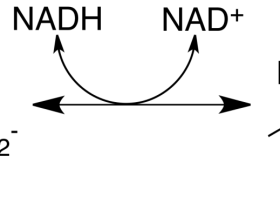
乳酸+辅酶Ⅰ 在乳酸脱氢酶的催化下可逆生成 丙酮酸+还原酶Ⅰ
LDH广泛分布于动物各种组织、植物和微生物之中。人体以肾含量最高, 心肌、骨骼肌次之, 红细胞的LDH 含量约为正常人血清的100 倍。在糖酵解的发生速率上,乳酸脱氢酶不是限速酶,故对发生速率影响不大。乳酸脱氧酶是由两种亚基组成的四聚体。

乳酸脱氢酶分子结构
LDH增高见于肝炎、肝硬化、肝癌、心肌梗死、横纹肌损伤、心肌炎、恶性肿瘤、肾病、肺梗死、巨幼细胞贫血、白血病、恶性淋巴瘤及妊娠等。胸水中的乳酸脱氢酶常用来鉴别漏出液或渗出液,若胸水中的LD比上血清LD大于0.6,则为渗出液。
LDH 同工酶的发现
1959年Markert发现牛心乳酸脱氢酶(LDH)结晶经淀粉胶电泳,可分成五条区带,首先提出了 “同工酶”的概念。同工酶一般指在同一种属内, 能催化同一底物进行相同反应而分子结构和理化性质不同的酶。乳酸脱氧酶有5种同工酶形式,即LDH1、LDH2、LDH3、LDH4、LDH5,可用电泳法进行分离。
LDH 同工酶的分布、组成和性质
电泳法可将人和动物组织LDH 分离成五种同工酶。靠近阳极一端的称LDH1 , 靠近阴极一端的称LDH5。 其余三种, 从阳极到阴极依次命名为LDH2 、LDH3和LDH 4 。人体心肌、肾、红细胞以LDH1和LDH2为最多。肝和横纹肌则以LDH4和LDH5为主。脾、胰、甲状腺、肾上腺和淋巴结等以LDH3较多。这说明LDH同工酶的分布有明显的组织特异性。LDH 同工酶的分子量都在140,000 左右,实验证明都是由四个亚单位组成的四聚体( 表一)
表一 LDH同工酶的亚单位组成
| 同工酶 | 亚单位组成 | 电极 |
| LDH1
LDH2 LDH3 LDH4 LDH5 |
B4 +
AB3 A2B2 ↓ A3B A4 - |
|
为什么不同组织的LDH同工酶谱不同呢?主要是因为A、B两种亚单位的含量不同, 人骨骼肌和肝细胞的A∶B为10∶1, 而人心肌为1∶20, 肾为1∶10。A亚单位和B 亚单位的生物合成分别受染色体上LDHA 和LDHB基因单位点的控制, 实验证明, 人LDHA 位点位于第11 号染色体上, LDHB 位点位于第12号染色体上。
LDH 同工酶由于A、B 亚单位的比例不同, 性质也不相同。现将人LDH同工酶的性质作一比较(表二)
表二 人LDH同工酶的性质
| 性质 | 同工酶 | ||||
| LDH1 | LDH2 | LDH3 | LDH4 | LDH5 | |
| 热稳定性(55℃)
对尿素的敏感性 2M尿素的抑制程度% 草酸盐的抑制程度% |
+++
2.3 15 68 |
++
1.7 76 66 |
+
1.2 88 61 |
+
1.0 90 47 |
0
0.9 95 31 |
乳酸脱氢酶同工酶是观察心肌疾病、肝胆疾病等重大疾病的指标之一:
单纯LDH1升高:细菌性细胞瘤(如,畸胎瘤、睾丸细胞瘤及卵巢坏死性细胞瘤)。
LDH1和LDH2升高:见于急性心肌梗塞(LDH1/LDH2>1)、病毒性心肌炎、风湿性心肌炎和克山病。
LDH2、LDH3及LDH4均升高:大量血小板破坏(如:肺栓塞、大量输血等)、淋巴系统疾病(如:传染性单核细胞增多症、淋巴瘤及淋巴性白血病等)。
LDH5和LDH4升高:1.急性肝炎:LDH5明显升高,LDH4轻度增高;2.急性肝萎缩:LDH5和LDH4都明显升高;3.慢性肝炎、肝硬化:LDH5轻度升高;4.骨骼肌急性损伤、皮肌炎:LDH5和LDH4都升高;5.前列腺癌:LDH5升高,LDH5/LDH1>1。
LDH5升高:骨骼肌炎症、损伤及退化、肝损伤(肝硬变、肝炎、肝过度充血)、癌。
总LDH升高而同工酶谱正常见于:心脏病、肝病、骨骼肌病、瘤及其他功能性失调症。对部分癌症患者LDH值越高,预后越不良。
LDH的五种同工酶都升高:见于胃癌、结肠癌和胰腺癌。
血清LDH同工酶的临床意义
乳酸脱氢酶同工酶结果要与临床症状结合才能做出准确判断。现将测定血清LDH同工酶相关的临床意义分述如下:
一.心肌梗塞:心肌的LDH活性比血清高数百倍, 故心肌少量受损, 血清LDH活力就明显增高。心肌LDH 同工酶以LDH1和 LDH2最多。急性心肌梗塞时, 血清LDH1 和 LDH2 显著增高,尤以LDH1 最著, 一些学者以LDH1∕LDH2 比值大于1 做为诊断心肌梗塞的特异指标。据统计有95% 以上的急性心肌梗塞患者血清LDH1活力相对增高, 使LDH1∕LDH2比值大于1 , 而且LDH1的增高比LDH 总活力增高出现的早。典型心肌梗塞患者血清LDH1 在梗塞发作后第3-5天达到高峰, 活力增高持续3周左右, 在心肌梗塞病程中SGOT和LDH总活力已恢复正常的病例,LDH1 仍可增高。但是在正常人的血清LDH同工酶分布中, 有13%的人LDH1〉LDH2, 根据酶谱进行诊断时应考虑到这一点。动物实验证明, 给狗造成心肌梗塞后6 小时, 血清LDH活力增高2-3 倍, LDH1 和LDH2 明显增高,3-4天后血清酶和同工酶逐渐恢复正常。心肌梗塞患者若伴有充血性心力衰竭时, 血清LDH1 和LDH5同时增高,血清LDH5增高可能是由于肝脏缺氧, 肝细胞膜通透性增强, 向血中释放大量LDH5所致。
病毒性心肌炎、风湿性心肌炎、克山病等血清LDH 同工酶的改变与心肌梗塞相似, 心绞痛、心包炎、心律失常等血清LDH同工酶谱正常。心绞痛反复发作疑为心肌梗塞时, 测定血清LDH同工酶谱可做出明确的诊断。血清LDH11 增高也是心脏移植患者排斥反应的早期生化指标。
二.肝脏疾病:人肝细胞中含有大量的LDH4和LDH5 , 故肝细胞受损可向血中释放大量的LDH4和LDH5。急性肝炎、传染性单核细胞增多症和中毒性肝炎时, 肝细胞显著受损, 血清LDH总活力增高3倍, 血清LDH5和LDH4 也明显增高, 其中以急性肝炎的LDH5 增高最著, 可增高10-50%,LDH4也轻度增高。在急性黄色肝萎缩症, LDH4和LDH5两者都明显增高。慢性肝炎、肝硬化等血清LDH总活力轻度增高, 血清LDH5或是轻度增高或无改变。肝硬化的血清LDH同工酶改变与病变程度和代偿程度有关, 在进展期失代偿病例以LDH5增高为特征。胆道系统疾的血清LDH及同工酶无改变。肝胞细性黄疸LDH5区带比阻塞性黄疽明显得多, 出现黄疽前两天就存在这种差别。溶血性黄疽以LDH1和LDH2增高为特征, 故LDH同工酶的测定对黄疸的鉴别诊断也有一定的帮助。
三.恶性肿瘤:Hill报告恶性肿瘤患者血清LDH 增高者占96%,但Zondag等报告474例恶性肿瘤患者血清LDH增高者只占41%, 同工酶有改变的占51%。恶性肿瘤患者血清LDH及同工酶的改变, 与肿瘤的种类、大小、有无转移等因素有关。特别是转移癌累及多种组织时, 可使同工酶谱的改变变得复杂。一般来说, 肿瘤常可引起血清LDH4 和LDH5增高, 有一些肿瘤则以LDH3 增高为特征。有的患者还出现附加的同工酶带。因而检测这些变化,可以达到检测肿瘤的目的。
四.肌肉疾病:骨骼肌以LDH4和LDH5最多, 假性肥大型进行性肌萎缩症患者的骨骼肌则以LDH 1、LDH2、和LDH3为主。患者的肌肉LDH 总活力较低, 但血清LDH 总活力和LDH1显著增高。肌肉LDH 总活力降低可能与肌肉细胞膜通透性增高有关。骨骼肌急性损伤、皮肌炎患者血清LDH 总活力、LDH 4和LDH5都增高。
五.肾脏病:肾皮质以LDH1 和LDH2 最多,肾髓质以LDH 4和LDH5最多。患急性肾小管坏死、慢性肾盂肾炎、慢性肾小球肾炎时, 血清LDH5增高, 接受同种肾移植的患者血清LDH5也增高。血清LDH5可否做为紧急排斥的早期指征尚不肯定,人工肾透析时血清LDH5也增高,正常人尿中的LDH大部分是LDH1, 患各种肾脏病时尿中LDH活力增高。
六.贫血: 恶性贫血患者血清LDH总活力显著增高, 其增高的程度与贫血的程度成正比,1∕3 患者血清LDH1和LDH2 显著增高,经大量维生素B12治疗后, 血清酶可迅速恢复正常,若治疗五天, 血清酶活力显著降低, 可确定诊断, 并说明药物剂量是适当的。溶血性贫血息者血清LDH1 和LDH2 也显著增高。
七.先天性LDH 缺陷症:北村等报告一例64 岁男性糖尿病患者, 糖尿病用甲苯磺丁脲治疗得到很好的控制, 但该患者的血清LDH总活力明显降低, 血清和红细胞中B亚单位完全缺失, 只能检出LDH5。此病病因或是由于基因调控机制发生障碍, 不能合成有活性的LDH1, 或者虽能合成酶蛋白, 由于变异而不具酶活性。
血清LDH同工酶的测定方法和正常值

1954年Hill等就将血清LDH活力的测定引入临床酶学, 作为诊断疾病的辅助手段。其后发现, 在心肌损伤、肝脏损伤、恶性肿瘤、血液病、肌病和肾脏病血清LDH活力均可增高, 特异性较低, 因而一度曾被其他血清酶活力的测定所取代。自从发现LDH同工酶后, 血清LDH 同工酶谱的改变能准确反映出患病组织的部位和程度, 观察病程的转归和疗效, 从而再次受到很大的重视。由于LDH同工酶的一级结构和性质不同,可采用多种方法进行分离和检测, 如电泳法,层析法、酶化学法以及免疫化学方法等。
电泳分离法主要是根据LDH同工酶的一级结构和等电点不同, LDH1 的等电点为PH4.5,LDH5的等电点为PH9.5, 因而在特定PH条件下( 一般为PH8.6) , 带有的电荷性质和数量不同, 在电场中泳动速度不同,利用适当支持物( 如醋酸纤维薄膜, 琼脂凝胶, 聚丙烯酞胺凝胶等)可将它们分开。经电泳分离后, 利用辅酶Ⅰ(NAD)、吩嗪硫酸甲酯(PMS)和亚硝基四氮哇兰(NBT)的混合液使酶显色力的区带显色, 最后用洗脱比色法或光密度计扫描定量。LDH同工酶显色反应的原理如下:
LDH首先催化乳酸脱氢,脱下的两个氢经NAD、PMS最后传递给给NBT,使氧化性NBT转变为还原型的NBT,后者又名甲酯,是一种不溶于水的蓝紫色化合物,其颜色的深浅与酶活力的大小成正比。
正常值:
琼脂糖电泳法:LDH2>LDH1>LDH3>LDH4>LDH5
LDH1:14.8%一25.9%LDH2:31.7%~41.4%LDH3:18.1%-25.9%LDH4:7.2%~13.6%LDH5:5.3%~16.5%
国内一些单位用电泳法测得健康人血清LDH同工酶的正常值如表三。
表三 健康人血清LDH同工酶的正常值
| 报告者 电泳支持物 | 同工酶百分数 | |||||
| LDH1 | LDH2 | LDH3 | LDH4 | LDH5 | ||
| 上海用北区中心医院
廷边医专 重庆医学院 张玲志 |
醋酸纤维薄膜
琼脂 醋酸纤维薄膜 聚丙烯酰胺凝胶 |
24-34
31.5 27.1 27.0 |
35-44
34.5 34.7 38.1 |
19-27
20.3 20.9 22.0 |
0-5
8.1 11.7 9.3 |
0-2
5.6 5.7 3.6 |
综上所述,LDH同工酶的测定在临床上有重要意义,其测定方法值得科研工作者不断探索,以便更准确的测定血清LDH同工酶谱,更好的为临床诊断服务。