细节是关键,PCR也是如此。这里教你几招重要的避免PCR TRAP的方法,你与成功之间就差了这几招,赶紧来瞅瞅!
PCR几乎是生物学实验室一项最基本的技能,然而有时并不是你想象的那样顺利,实验中的一些小细节可能会使这看似简单的实验失败。
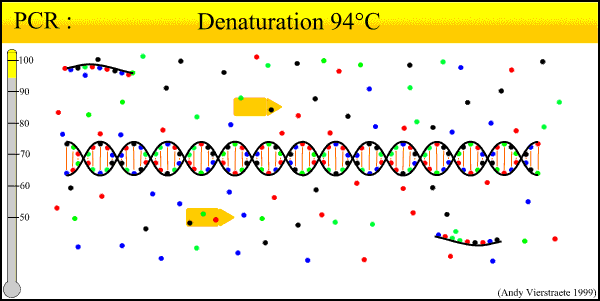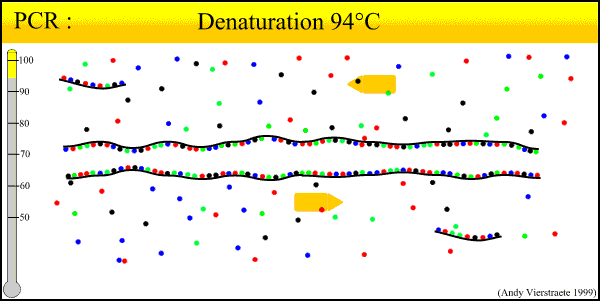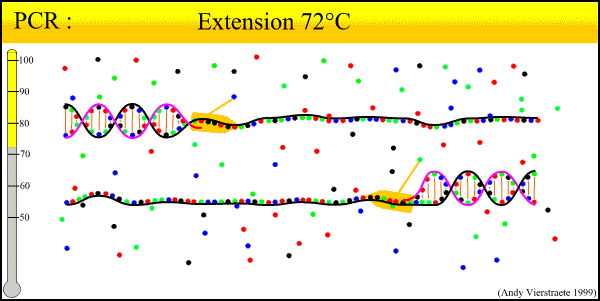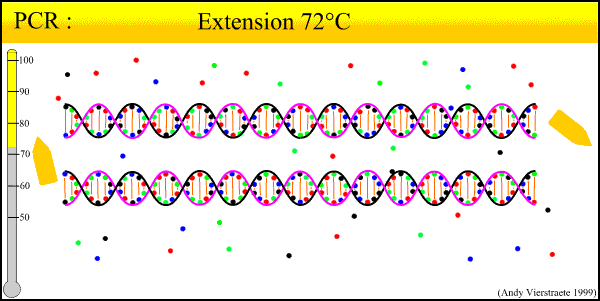
陷阱一:起始模板不合格
良好的开端往往带来成功的结局,使用高质量的DNA模板对于最终得到的PCR产物是至关重要的。理想情况下,最好的DNA样本是一个新鲜的样本,然而并不是每次都可以达到这样,最好选择冻结/解冻周期最小的样品。
对于50µl标准的PCR反应,使用25 - 100 ng的人类基因组DNA。为了防止过量的DNA造成反应过量,生成不确定的产物,应该将DNA进行一系列的稀释,分别进行PCR来验证你的反应的极限。
分光光度计可以检测DNA的浓度和质量。分析样品的质量,计算样品A260/280和A260/230吸光度值的比率,比率大于1.8通常是很好的,较低的比值表明样品有污染。常见的污染物,如血红蛋白、乙醇、苯酚是强有力的PCR抑制剂。例如,低A260/230值表示有盐或溶剂污染,而低A260/280值可能有蛋白质污染。如果有污染,及时进行清理。
陷阱二:一级序列和二级结构
在设计引物时,注意那些可能会扰乱反应的一级和二级结构,最好避免AT和GC丰富的区域,选择上游或下游的其他区域。当然,如果克隆一个特定的区域时就没有办法了,一些基本的技巧处理这些复杂的基因序列:
对于富含AT的区域,使用比标准的18-22bp更长的引物。此外,在这种情况下使用两步PCR能达到很好的效果(没有单独的延长步骤);简单地,删除延长步骤并延长退火时间。也可以试着添加额外的MgCl2至10Mm.
对于富含GC区域,特别是当GC含量< 60%时,由于形成稳定的二级结构,会停止或降低聚合酶反应。在没有延长熔融期的情况下,可能很难熔化一些GC含量高的结构。一些添加剂,如DMSO可以降低DNA的熔化温度。可以尝试添加5-20% DMSO,5-20%甲酰胺,1-3M甜菜碱或0.01-10mM四甲基铵帮助融化这些结构。
陷阱3:使用错误的试剂或操作错误
如果一个标准的PCR反应突然不运行了,有可能是你的试剂问题。Taq聚合酶、dNTPS和引物有可能发生了降解。如果你认为可能是这个问题,更换新的试剂,检查它们是否稀释到正确的浓度。确保引物浓度在0.1-0.5µM,dNTPs浓度在200µM。另外,不同的PCR程序需要使用不同的聚合酶,根据你所需要的PCR产物特点,比如高保真酶减少产物发生序列错误。
如果以上都试过了都没有效果,尝试校准你的吸量管,或者,回顾一下确定没有忘记添加某个重要的试剂。
陷阱4:没有优化反应条件
优化反应条件是很有必要的,推荐的退火温度当然是很好的,但你不能以为这就是最理想的,调整适当的退火温度可以降低非特异性产物如引物二聚体的形成。








