光遗传学(optogenetics)是一门2005年才诞生的生物工程技术,目前正在迅速发展,它整合了光学、软件控制、基因操作技术、电生理等多种学科。当年斯坦福大学Karl Deisseroth实验室通过在神经细胞中表达光敏蛋白,响应不同波长的光刺激实现对神经功能的调控,宣布人类正式拥有了精准操控大脑的工具。这是一项令人激动的技术。长久以来,我们对神经元之间作用的相互理解仅仅停留在相关性上,有了光遗传学,我们现在终于有能力探究特定的神经回路和大脑功能之间的因果关系。而且这项技术微创、精准,作为神经科学研究工具来说,无疑是个跨越式的进步。最近光遗传学又有了新的突破。
11月13日的《自然神经科学》上,麻省理工学院和巴黎笛卡尔大学研究者公布了一项研究成果,他们通过结合新型光敏蛋白soCoChR与双光子计算机生成全息技术(CGH),成功提高了现有光遗传学技术的精确度,实现了对单个神经元的光敏操作,并将响应时间压缩至1毫秒内——这已经和真正的神经元活动相差无几。下面我们跟随科学家们的脚步一起踏上这奇幻之旅:
光遗传学被<自然>杂志评选为“2010年度最受关注科技成果技术”之一,同年《科学》杂志也在十年技术回顾中着重强调了这项进展。Nature Methods杂志在十周年之际推出了纪念特刊,点评了在过去十年中对生物学研究影响最深的十大技术,其中就包括光遗传学技术。2015年,《自然神经科学》为纪念光遗传学十周年特地撰文,直言“光遗传学打开了通往梦寐以求的实验的大门”。有科学家预言,“光遗传学注定会获得诺贝尔奖”。
而这项最新研究,在原有的基础上改造了光敏蛋白,减少了对周围神经细胞的干扰,并利用最新的显微技术,使光刺激的范围更加精准、有效的光照时间更短,实现了与真实神经活动相似的刺激,将光遗传学技术带到了一个新的高度。这意味着,我们将要能够随心所欲地操纵独立的神经元,探索它们彼此相互作用的机制,我们将要揭开人体最神秘器官——大脑的最后一层面纱。
人类一直没有停止对大脑的探索。这个人体最为复杂的器官,拥有上百亿个细胞,它们之间的连接构成了巨大的网络。在这张网里,时刻传递着海量的信息,构成我们的思考、言语和行动。如此庞大的信息流,我们用尽手段得以窥探的不过寥寥,又如何能够代表整个大脑呢?
科学家响应了上帝的旨意——神说,要有光。
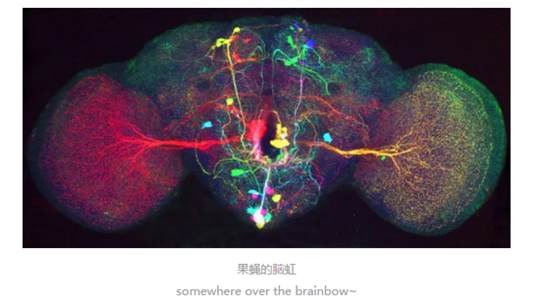
1962年,下村脩从一种水母中发现了荧光蛋白(GFP),正式开启了生物发光研究的大门。2008年,诺贝尔化学奖颁给了绿色荧光蛋白,由下村脩、Martin Chalfie以及美籍华裔科学家钱永健共同受奖。荧光蛋白带来的最典型、也最绚烂的研究莫过于脑虹(Braibow)。2007年,Joshua R. Sanes 和Jeff W. Lichtman主持的一项研究将红黄蓝三种颜色的荧光色素嵌入老鼠基因组,成功为老鼠的不同细胞涂上不同颜色。三种颜色相互组合,最终展现在显微镜下的老鼠脑干组织切片上有近百种颜色标记,如同一道绚烂的彩虹。
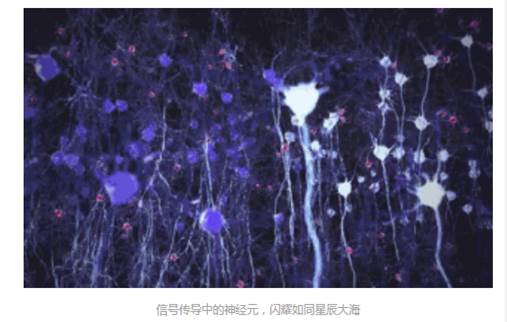
这让我们清楚看到了大脑内不同细胞交织在一起的绝妙画面,也带来了更深一层的问题——这些细胞之间,是怎么互相作用的呢?在单个神经元细胞中,信息以电信号的形式传播。随着信号传导,细胞膜内外电位逆转,随之而来的还有大量钙离子内流。传统方法是用电极测量神经细胞上的电位变化,但这种方法缺陷十分明显,毕竟需要的器材多、能够观察的范围有限。有了荧光蛋白,科学家找到了解决的方法。在荧光蛋白上连接能够感应电压或者钙离子浓度变化的蛋白,那么在神经元参加大脑活动的时候,它就会发出耀眼的闪光。
在经典的生物学实验中,控制神经细胞需要一些比较粗暴的手段,电刺激、切脑区、或者是加一些化学物质。费时费力不说,达到的实验效果也并不是那么尽如人意。长久以来,神经学家们一直梦想着,能够以精确的时空精度控制神经元活动。这个梦想被光遗传学(optogenetic)实现了。光遗传学的灵感实际上来自我们的视觉。人眼中有重重的感光细胞,外界的光线进入我们的眼睛,在视网膜后转变为化学信号和电信号,通过神经元的传输进入大脑。那我们是不是也可以通过光来给神经元下命令,操控它们的活动呢?
2002年,斯隆凯特琳癌症研究中心的Gero Miesenböck教授率先尝试了这个大胆的想法,他把来自无脊椎动物的感光蛋白表达在大鼠细胞上,并在培养皿中看到了神经元响应光刺激!2005年,他成功实现了利用光控制无头的果蝇扇动翅膀!Gero Miesenböck本人也被称为光遗传学的奠基人。而2003年,单个光敏通道蛋白(channelrhodopsin)ChR1和ChR2的发现,促使顶级科学家们开始尝试在哺乳动物细胞中表达光敏蛋白。ChR1和ChR2是一种光控的离子通道,能够响应光刺激进行胞内外离子转运,实现类似神经元活动的电位变化,还能够连接荧光蛋白使刺激过程可视化。最终斯坦福大学Karl Deisseroth实验室获得了科研竞速的胜利,论文登上《自然神经科学》。论文的一作是Edward S Boyden,二作则是我们颇为熟悉的CRISPR小王子张锋。
自此,光遗传学的时代来临了。
在2005年8月至2006年4月的残酷竞争中,共有四家实验室发表了相关成果,其中美国韦恩州立大学的潘卓华实验室所做的工作最为全面,从体外细胞表达到小鼠视网膜细胞中表达再到电生理记录,一应俱全。
据潘卓华介绍,实际上在2004年底,他们就已经完成了相关工作,可是由于各种原因,直到2006年4月,文章才得以在《神经元》杂志上发表。
2005年5月,潘卓华带着他的研究成果到佛罗里达州的罗德岱堡参加视觉和眼科学研究协会(Association for Research in Vision and Opthamology)的会议,在那里进行了一场仅有短短15分钟的演讲。几个月之后,Deisseroth实验室成果发表,全美为之震动。相比美国学者获得的高额经费与媒体的热捧,之后的十年间潘卓华获得的资助却仅仅够维持研究。如今,潘卓华老师依旧在从事光遗传学研究,他说:“我的实验室很小,我们想让更多人重获光明。”
相比起传统的研究方法,光遗传学确实有着无可比拟的优点。它只需要向细胞内转入一个蛋白,实际操作性高;以光作为刺激媒介,具有高时效性;对实验动物的创伤远远小于传统方法,且没有异物侵入组织;可以用定位的光纤来局部刺激细胞,也可以设计弥散光大范围刺激脑区。不过,光遗传学仍旧还有改进的空间。大脑中的神经细胞种类可能远远超出我们的想象,即使两个相邻的同类型细胞,或许也会有完全不同的功能,仅仅对单个的神经元进行刺激,就可能改变大脑的状态和行为。
以当年的技术来说,一方面神经细胞的轴突、树突互相交联,光敏蛋白的响应信号很容易就干扰到周边的神经细胞;另一方面,光技术也没有达到某一个细胞的精度。为了实现对单细胞的光刺激,研究者借助了两个新工具:更灵敏、定点更准确的光敏通道蛋白,和优化的全息双光子显微镜。Boyden博士想到了用基因工程改造光敏通道蛋白。2014年,Boyden博士团队发现了一种新的光敏通道蛋白CoChR,它对光更敏感、产生的电流更强,大概是第一代光敏通道蛋白ChR2的十倍。在CoChR的基础上,Boyden博士给它添加了一个红藻氨酸受体(kainate recepter)KA2的残基。经过改造之后,新的光敏通道蛋白soCoChR可以集中在神经细胞的细胞体中,避免了轴突和树突对周边神经细胞的干扰。实际光刺激后可见对比CoChR(上),soCoChR(下)对周边神经元细胞几乎毫无影响。
解决了干扰的问题,巴黎笛卡尔大学的Valentina Emiliani教授提供了最新的激光技术,双光子计算机生成全息技术(two-photon CGH),达到了对时间和空间的精准控制,能够在照亮细胞的同时将照明时间最小化,将响应时间降低到毫秒级。同时这种技术还支持3D成像,奠定了生成复杂模型的基础。Boyden教授说,使用这种单细胞光遗传技术,研究者可以精确刺激指定神经元,观察与其相连的细胞的反应;又或者,我们可以刺激彼此相邻的几个神经元,看看它们是由哪一个主导,还是共同接受其他神经元的控制。这将会帮助人们理解思考、感觉和运动是如何发生的。
其实光遗传学的潜力还不仅仅限于作为神经学研究的工具。正如《自然神经科学》评论文章中说道的那样,光遗传学无论是在神经科学领域内、还是其他领域都得到了广泛的应用。
近十年来,临床医疗研究者也在尝试利用非入侵性的光遗传学手段来治疗各种疾病,例如嗜睡、抑郁症、恐惧、焦虑、疼痛和帕金森。比如:恢复记忆,治疗阿尔茨海默、失明和糖尿病。光敏通道蛋白本身的结构也给了研究者灵感。虽然名为通道,但ChR2却没有典型通道的结构,它在细胞膜上反复穿越7次,更像一个G蛋白偶联受体。由此研究者脑洞大开,是不是可以通过工程改造,把原本不受光影响的蛋白改造为光敏蛋白呢?当我们想得更远,为什么光遗传学的光控受体一定要是蛋白,不能是DNA或者RNA吗?可以用其他的介质来控制细胞吗?面对科学,前路漫漫,吾等将上下而求索。