在前面的《 大有可为的纳米疫苗技术》一文中我们给大家介绍了纳米疫苗技术,今天我们再来了解下相关的纳米抗肿瘤药物。癌症的发病率越来越高,越来越多的人因为癌症离世,科研工作者们致力于寻找能用于抗肿瘤的纳米药物。
首先说下纳米粒,通过过去几十年的努力,我们知道了纳米粒的粒径要在10-100纳米之间。有两种已经开展临床试验的纳米粒。第一种包载了小分子药物;第二种包载了RNA。
包载小分子药物
科学家基于一种叫做环糊精的多糖构建了全新的聚合物。临床上,一种称为Sporanox的环糊精药物的最大耐受剂量是8克,环糊精是安全低毒的,可以利用环糊精构建多功能聚合物材料,首先构建了以环糊精为骨架的线性聚合物。他们构建的第一个纳米粒包载的小分子药物是喜树碱,它的作用机制是抑制拓扑异构酶Ⅰ。尽管喜树碱对多种癌症有效,但是由于喜树碱本身毒性很大,因此并没有产品上市。目前,基于喜树碱母核通过官能团结构修饰,已经有了两种上市药物,并且每年销售额高达10亿美金(尽管仍有毒副作用)。
他们合成了以环糊精和聚乙二醇为重复结构单元的聚合物。它可以被想象成一根很长的带有结扣的软绳。结是环糊精,绳子则是环糊精之间的聚乙二醇,将喜树碱分子系在聚合物链上。当这个聚合物在水中时,喜树碱因不溶于水而进入环糊精的疏水腔中,他们将这种形式称为“主客体复合物”。一些喜树碱分子进入同一条链上的环糊精内,其他链上的分子则进入其所在链上的环糊精中。
如果按照设计顺利进行的话,这将会形成含有5-10个聚合物支链、略带负电、粒径大约为30纳米的颗粒。这种纳米粒最初被称为IT-101,现在则叫做CRLX101。这种纳米粒必须能够在适当的时机解聚,否则会由于尺寸太大而长时间滞留在肾脏中。因为纳米粒的稳定是因为喜树碱与环糊精之间的相互作用,因此当药物被释放之后纳米粒自然而然就会解聚成链状聚合物。这些链状聚合物的大小与分子量足以使其随着尿液排出。总而言之,这种纳米粒能够在体内循环,随后进入肿瘤部位,内化进入细胞,将药物释放,解聚成链状聚合物之后随着尿液被排出体外。
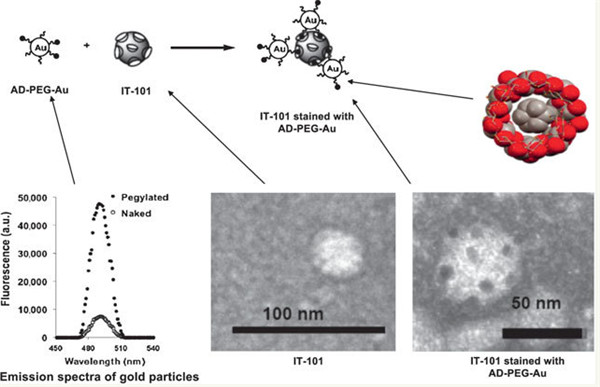
图片来源知乎
科学家也利用纳米技术去观察纳米粒聚集在肿瘤部位的行为。他们制备了5纳米的金-聚乙二醇-金刚烷复合物(Au-PEG-AD)。由于金刚烷分子可以紧密地嵌合在环糊精内腔,因此我们可以通过对Au-PEG-AD荧光成像去观察CRLX101在组织中的分布。上图展示了CRLX101和表面修饰了Au-PEG-AD的CRLX101在肿瘤部位的透射电镜图片。通过Au-PEG-AD成像我们可以清楚地观察到CRLX101进入了肿瘤组织和细胞。
如上所述,可以通过化学修饰手段,使得纳米粒仅仅在肿瘤部位程序性缓慢释放药物,而且这种释放可以持续很长一段时间,这意味着我们将会得到一种能够特异性地在肿瘤部位持续释放的抗癌药。
RNA疗法
我们现在要展示一种递送RNA片段的癌症疗法。我们知道,细胞通过多条信号通路调节其生长、分裂和死亡。肿瘤细胞的信号通路与正常细胞相比是有区别的,这使得肿瘤细胞可以无限生长。我们希望创造一种依据患者自身情况来选择性调节信号通路的疗法。一种叫做RNA干扰(“RNA interference (RNAi)”)的新兴技术可以帮助我们。含有20-25个碱基对的双链RNA进入细胞后可以实现与特定蛋白的结合,这些与RNA相互作用的蛋白可以在信使RNA(mRNA)间穿梭、排列,然后在特定部位剪切mRNA。一但mRNA被破坏,其翻译的蛋白的合成将终止。
因为这项技术的发现,Craig Mello和Andrew Fire获得了2006年诺贝尔生理学或医学奖。当时他们是在秀丽隐杆线虫上进行的操作,但从秀丽隐杆线虫研究到人体的应用需要付出巨大的努力。2010年,科学家们第一次实现了在患者体内进行RNA干扰治疗。Fire曾说:“对于肿瘤患者,我们为什么不利用双链RNA去干扰特定的基因使其沉默,进而控制肿瘤的生长?”(https://www.nobelprize.org/nobel_prizes/medicine/laureates/2006/fire_lecture.pdf)——这正是我们所做的事情。
绝大多数药物的作用机理是与行使特定功能的蛋白质结合从而影响其行为。但如果我们去调控mRNA,我们需要做的仅仅是考虑更改双链RNA的碱基对顺序。理论上讲,我们可以调控任何基因,尤其是对于一些无法针对其设计药物的蛋白,这个调控策略是很有前景的。这项治疗技术可以把目前癌症治疗化学上的难题转变成信息学的问题。因为从化学角度看,双链RNA的本质是一样的,我们需要做的仅仅是查出有问题的基因是什么。
这个过程可以类比为浴室中水龙头与浴池的关系。我们通常情况下将水龙头打开,等到水快满时,我们再将水龙头关闭。这与细胞调控未突变基因的表达是一样的。当基因突变之后,类似于水龙头一直是打开的,水即使溢出水龙头也不会关闭。突变的细胞中蛋白持续表达,生长一直持续而不会停止。传统的药物作用在蛋白水平,蛋白持续合成,药物需要尽可能多地去与蛋白作用来抑制其功能。但如果利用RNA干扰技术,我们就拥有了关闭水龙头的能力,彻底抑制住蛋白的生成,一劳永逸。这是一种拥有良好临床应用前景的方法。
总而言之,科学家制备了一种可以装载双链RNA的聚合物纳米粒,为了使其更好地靶向肿瘤细胞,他们在其表面进行了修饰。这些RNA片段要比小分子药物大得多。他们利用环糊精纳米粒装载了大约2000个RNA片段,同样利用Au-PEG-AD来对纳米粒进行荧光成像,通过荧光追踪观察纳米粒在肿瘤组织的渗透、肿瘤细胞的内化与RNA的释放行为。这项临床研究开始于2008年春季,2010年首例RNA干扰的临床研究结果被报道(Evidence of RNAi in humans from systemically administered siRNA via targeted nanoparticles)。
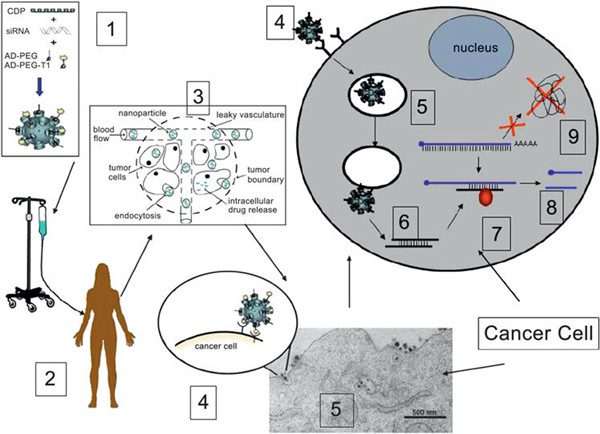
图片来源知乎
上图展示了这些纳米粒从制备到进入病人肿瘤细胞内发挥作用的全过程:它们在血液中循环(3),渗透进肿瘤组织(4),内化进入肿瘤细胞(5)。这些纳米粒上被修饰了在到达内涵体后可以产生反应的化学感应器,使其可以从内涵体逃逸(6)并释放RNA,RNA与功能性蛋白质结合并被引导靠近mRNA(7),切断mRNA(8),抑制相应蛋白质的表达(9)(The First Targeted Delivery of siRNA in Humans via a Self-Assembling, Cyclodextrin Polymer-Based Nanoparticle: From Concept to Clinic)。如果一切按照他们的设计进行的话,将会观察到mRNA表达减少,蛋白质表达降低,新RNA片段产生。他们幸运地观察接受3个不同剂量(18,24,30mg-siRNA/m2)患者的活检结果:利用Au-PEG-AD成像观察最低剂量组,没有观察到纳米粒;观察中间剂量组,看到了部分纳米粒;观察最大剂量组,观察到了很多纳米粒。一个月后对患者进行活检,发现纳米粒全部降解成足以经肾脏排出的小片段。重复给药后可以重新观察到纳米粒,证明这种疗法的可重复性很高。这是纳米粒经静脉注射后,呈剂量依赖性地蓄积在肿瘤细胞中的首例临床报道。
一个鼓舞人心的结果是并没有在肿瘤附近的正常组织中发现纳米粒。这表明纳米粒依赖EPR(Enhanced Permeability and Retention Effect)效应全部蓄积到了肿瘤组织,而不会产生其他毒副作用。
当他们进行组织切片染色时,在显微镜下发现希望表达减少的蛋白确实得到了抑制,mRNA的量也有所减少。另外我们对给药后的RNA片段进行序列检测,发现mRNA确实通过RNA干扰机制在目标部位被切断,证明了RNA干扰可以成功应用于临床治疗并使患者的生存质量得以提高。
最新进展-纳米细胞免疫疗法
目前,免疫肿瘤学领域主要集中于CAR-T治疗或检查点抑制剂,两者均旨在使细胞毒性T细胞靶向癌细胞。但是,研究表明要实现更强大的抗肿瘤免疫反应,则需要刺激几种不同类型的免疫细胞。
有一种新型的EnGeneIC Dream Vector(EDV™)技术能够刺激先天免疫和适应性免疫反应。EDV™技术是利用基因工程改造过的细菌分裂形成的直径为400纳米的纳米细胞。在这些纳米细胞中可以携带抗肿瘤的小分子药物、siRNA或者miRNA。同时,这些纳米细胞表面可以连接靶向肿瘤的抗体,使细胞能够与肿瘤结合,被肿瘤细胞吞噬并且在其内部释放出携带的药物,具有强大的抗肿瘤能力以及能够延长肿瘤缓解期。由于EDV 纳米细胞来源于细菌,它们在被巨噬细胞或树突状细胞吞噬后能够起到激活免疫系统的作用。EDV 纳米细胞通过激活巨噬细胞,NK细胞和树突状细胞来刺激先天免疫反应,随后产生的适应性免疫反应是将特定的肿瘤杀伤性CD8+T细胞募集到肿瘤微环境中。
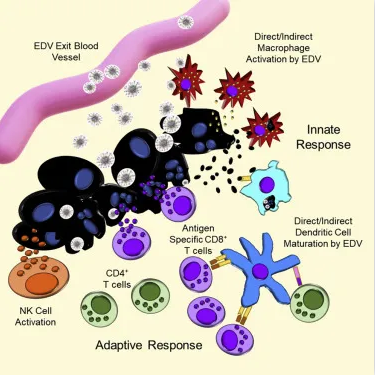
▲ EDV 纳米细胞机制图( 图片来源:cell)
首先,EDV 纳米细胞靶向肿瘤并释放细胞毒素,随后这些纳米细胞极化M1巨噬细胞,激活NK细胞,同时产生Th1细胞因子反应,从而产生强大的抗肿瘤功能;随后树突状细胞成熟和抗原递呈,产生肿瘤杀伤性CD8+T细胞,延长肿瘤缓解期。细胞毒素传递和先天及适应性抗肿瘤免疫反应的相结合,产生了一种具有临床肿瘤学潜力的强有力的细胞免疫治疗。这项工作为许多耐药的晚期肿瘤患者提供了一个新的治疗选择,且毒性很小或者没有毒性,与其他免疫疗法相比,成本较低。
EnGeneIC的首席执行长,该研究的资深作者Himanshu Brahmbhatt博士说:“ 我们团队对最新发表的科学论文感到兴奋。我们首次展示了一种治疗方法,既具有有效载荷细胞毒素的能力以杀死癌细胞,还可以启动已耗尽的免疫系统。这种两管齐下的疗法在早期人体试验中显示出初步的成功。”
目前,该公司正在澳大利亚进行临床试验,以评估EDV™在多种癌症适应症中的应用,包括已用尽治疗选择的IV期胰腺癌患者。该试验还为患有各种其他晚期EGFR表达实体瘤的患者提供了第二个全能队列。
Brahmbhatt博士继续说道:“ EDV™治疗并不是一种零碎的癌症治疗方法,其刺激了攻击肿瘤所需的所有关键免疫细胞。当我们耗尽每种细胞类型时,抗肿瘤作用就会减弱。我们期待EDV™纳米细胞技术平台的发展,为患者带来更多的机会。”








