| Abbikine产品:Anti-GST Tag Mouse monoclonal antibody (A02030, Abbkine, Wuhan, China) 英文名:The polymeric immunoglobulin receptor-like protein from Marsupenaeus japonicus is a receptor for white spot syndrome virus infection 中文名:MjpIgR的聚合免疫球蛋白受体样蛋白是白斑综合症病毒感染的受体 作者单位:山东大学生命科学院,动物细胞和发育生物学省重点实验室 研究方向:动物细胞和发育生物学 杂志名称:PLoS Pathogens (2019) 影响因子:6.02 |
研究背景
病毒感染过程是一个非常复杂的相互作用,包括多个步骤。它从病毒体附着到宿主细胞膜开始,然后与受体特异性结合。病毒受体的结合使病毒可以将其基因组直接在质膜上释放到细胞中,或者通过内吞作用进入细胞。内吞作用是高度复杂和动态的,并且涉及内吞小泡的再循环,运输,成熟和融合。对于DNA病毒和一些RNA病毒,内吞病毒会从细胞质运输到细胞核中进行基因表达。为了进入宿主细胞的细胞质,病毒可以采取两种主要策略,受体介导的内吞作用和独立于内吞作用的受体介导的进入。病毒可以使用特定的细胞膜受体进入并感染宿主细胞,这决定了病毒可以感染的宿主特异性,组织嗜性和细胞类型。几类分子被脊椎动物中的不同病毒(例如唾液酸部分,整联蛋白和一些免疫球蛋白样超家族(IgSF)蛋白)用作受体。一些病毒使用各种类型的受体附着并进入细胞。例如,在哺乳动物中,丙型肝炎病毒(HCV)感染的受体包括硫酸肝素,低密度脂蛋白受体,转铁蛋白受体1,B型清除剂受体和闭合蛋白。
细胞粘附分子可分为四个蛋白质家族:整合素,选择素,IgSF和钙黏着蛋白。它们通常在细胞表面表达并具有多种功能。其中,IgSF是细胞表面和可溶性蛋白的大蛋白超家族,与识别,结合,粘附和免疫有关。 IgSF成员在顺序和功能上存在分歧;然而,成员的明确特征是存在一个或多个免疫球蛋白(Ig)样结构域。在脊椎动物中鉴定出的聚合免疫球蛋白受体是IgSF的成员。作为I型跨膜糖蛋白,聚合体免疫球蛋白受体(pIgR)在上皮细胞中广泛表达pIgR在虾中起WSSV受体的作用。利益冲突:作者宣称不存在利益冲突。不同物种中的pIgR蛋白共有四个相似的组件:一个细胞内区域,一个跨膜区域,一个切割区域和一个细胞外配体结合区域(分泌成分,SC)。 Ig结构域位于细胞外区域。因此,N末端配体结合结构域在结合聚合物免疫球蛋白(pIg)中起核心作用。 PIgR充当pIg的受体,并在脊椎动物的肠上皮细胞(IEC)中转运pIgA/pIgM。此外,pIgR和SC介导的保护作用可防止病原微生物侵入粘膜表面。有趣的是,有关pIgR的一些研究发现,某些微生物(例如肺炎链球菌)会在入侵宿主细胞的过程中劫持pIgR以使其自身受益。
白斑综合症病毒(WSSV)是虾类养殖中最具毒性的病原体之一。对涉及WSSV感染的病毒候选受体的研究可以为控制病毒性疾病提供有用的信息。关于虾中WSSV附着蛋白或候选受体的报道有好几种,例如斑节对虾Rab7与WSSV包膜蛋白VP28结合,这有利于WSSV感染,斑节对虾中的几丁质结合蛋白(CBP)与11种WSSV相互作用包膜蛋白,可降低和延缓中和试验中WSSV攻击时的死亡率。 Beta-整合素与VP187相互作用,可以介导WSSV感染。葡萄糖转运蛋白1与VP53A相互作用,这与WSSV进入宿主细胞有关。层粘连蛋白与VP31的结合介导了WSSV感染,可溶性C型凝集素(MjsvCL)与VP28和钙网蛋白相互作用,从而促进了虾中WSSV的感染。其他研究发现,某些蛋白质与WSSV蛋白质相互作用以抵抗WSSV感染。南美白对虾的F1-ATP合酶β亚基与WSSV结合并减弱WSSV感染。日本Marsupenaeus japonicus的清道夫受体C与WSSV的VP19相互作用,β-arrestin介导WSSV的网格蛋白依赖性内吞作用,这可以限制病毒的增殖。这些报告进一步提高了我们对WSSV进入受体的理解。
病毒受体在病毒感染的初期起着重要作用,并且是抗病毒干预的理想靶标。通常,病毒与受体的相互作用可以引发两种信号,病毒颗粒构象变化和触发特定细胞反应的细胞内信号。在许多情况下,病毒可以篡夺宿主细胞的信号系统,为其自身扩增创造良好的环境。在报道的对WSSV感染有益的WSSV候选受体中,只有β-整联蛋白是真正的跨膜蛋白。因此,需要进一步研究WSSV进入受体。另一方面,由WSSV与受体相互作用引起的信号传导仍然未知。在本研究中,我们鉴定了一个类似于日本滨海脊椎动物的多免疫球蛋白受体(pIgR)的IgSF细胞粘附分子,并将其设计为日本滨海pIgR样蛋白(MjpIgR)。 MjpIgR是I型跨膜蛋白,pIgR作为虾中的WSSV受体在受到WSSV攻击的虾中显着上调。敲除虾中的MjpIgR减少了WSSV的数量。同时,MjpIgR的过表达增加了WSSV感染。研究了WSSV与MjpIgR相互作用触发的细胞内信号传导。 MjpIgR与MjCaM相互作用,病毒内在化是网格蛋白依赖性的。我们的研究表明,pIgR是WSSV入侵虾的受体。
实验目的
病毒进入宿主细胞是成功感染的第一步。病毒的进入始于病毒体的附着,并与受体结合。受体结合病毒要么直接将其基因组释放到细胞中,要么通过内吞作用进入细胞。对于DNA病毒和一些RNA病毒,内吞病毒会从细胞质转运到细胞核,然后进行基因表达。细胞膜上的受体在病毒感染中起关键作用。尽管在虾中发现了几种感染白斑综合症病毒(WSSV)的附着因子或候选受体,但尚不清楚WSSV感染的真正进入受体以及由WSSV与受体相互作用触发的细胞内信号传导。在本研究中,鉴定出了黑斑虾Marsupenaeus japonicus中WSSV感染的受体。它是具有跨膜区的免疫球蛋白超家族(IgSF)的成员,与脊椎动物的聚合体免疫球蛋白受体(pIgR)相似;因此,它被指定为pIgR样蛋白(简称MjpIgR)。
在所有测试的组织中均检测到MjpIgR,WSSV感染在mRNA和蛋白水平上均显着诱导了MjpIgR的表达。击倒MjpIgR,用其抗体使MjpIgR膨胀,可抑制虾中WSSV的感染,MjpIgR的过表达促进了WSSV的入侵。进一步的分析表明,MjpIgR可以独立地使非许可细胞易受WSSV感染。 MjpIgR的胞外域与WSSV的包膜蛋白VP24相互作用,而胞内域与钙调蛋白(MjCaM)相互作用。 WSSV感染后,MjpIgR被寡聚化和内化,并且内化与WSSV的胞吞作用有关。 MjpIgR的病毒内在促进能力可以用氯丙嗪(一种网格蛋白依赖性内吞作用的抑制剂)阻断。抑制Mjclathrin及其衔接蛋白AP-2也抑制了WSSV的内在化。所有结果表明,MjpIgR介导的WSSV内吞作用是网格蛋白依赖性的。结果表明,MjpIgR是WSSV受体,并且WSSV通过pIgR-CaM-Clathrin内吞途径进入虾细胞。
作者总结
白斑综合症病毒(WSSV)是虾类养殖中最具毒性的病原体之一。在以前的研究中已经报道了几种病毒候选受体或附着因子,但是,大多数不是真正的跨膜蛋白。具体而言,尚不清楚通过WSSV与受体相互作用触发细胞内信号传导所需的蛋白受体。在本研究中,在库鲁马虾体内,我们发现一种蛋白Marsupenaeus japonicus(简称MjpIgR),它是一种聚合物免疫球蛋白受体(pIgR)样蛋白,即真正的跨膜受体。我们通过RNA干扰抑制MjpIgR表达,并通过其抗体阻断MjpIgR蛋白,可以防止虾中WSSV的感染,MjpIgR的过表达促进了WSSV的入侵。
进一步的研究发现,MjpIgR可以独立地使非易感细胞易受WSSV感染。 MjpIgR的细胞外结构域与WSSV的包膜蛋白VP24相互作用,而细胞内结构域与钙调蛋白(MjCaM)相互作用。WSSV感染后,MjpIgR被寡聚化和内化,并且内化与WSSV的胞吞作用有关。 MjpIgR的病毒内在促进能力可以用氯丙嗪(一种网格蛋白依赖性内吞作用的抑制剂)来阻断,这表明MjpIgR介导的WSSV内吞作用是网格蛋白依赖性的。结果表明,MjpIgR是WSSV受体,并且WSSV通过pIgR-CaM-Clathrin内吞途径进入虾细胞。该研究为对虾养殖中的WSSV控制提供了新的目标。
材料与方法
- 实验动物:从山东省济南市的一个海鲜市场购买健康的m .对虾(每只9克至12克)。 将虾放在充气鱼缸中用约24摄氏度的人工海水驯化48小时。 海水的盐度保持在24‰之间。
- cDNA克隆和序列分析
- WSSV侵袭感染和组织采集
- RNA提取,cDNA合成,DNA和蛋白提取
- MjpIgR的重组表达,纯化,抗血清制备
- WB实验
- RNA干扰和抗体阻断试验
- 免疫组织化学分析
- 荧光标记的WSSV和MjpIgR的共定位
实验结果
- WSSV攻击使虾的MjpIgR表达上调。
在我们的转录组序列分析中,我们发现在受到WSSV攻击的虾中,pIgR样分子被上调了4至6倍。 因此,我们选择了该分子作进一步研究。 MjpIgR cDNA的全长为1686 bp,编码562个氨基酸残基的蛋白质。 MjpIgR含有信号肽; 细胞外结构域,包括IG结构域和两个IG样结构域; 跨膜区; 和细胞内区域。 MjpIgR与脊椎动物pIgR组聚集在一起。
MjpIgR mRNA在血细胞和所有其他受检器官中表达,包括通过RT-PCR分析的心脏,肝胰腺,腮,胃和肠(图1A)。 MjpIgR ORF引物的特异性已通过使用凡纳滨对虾和克氏原螯虾的其他样品得到证实,该样品通过PCR扩增未显示任何条带。 MjpIgR蛋白的细胞外SC在大肠杆菌中重组表达(图1B),并制备了抗MjpIgR多克隆抗体(图1C)。 MjpIgR蛋白也广泛分布在血细胞和其他器官中,如通过蛋白质印迹分析所揭示的(图1D)。 所有结果表明,MjpIgR在虾中普遍表达。
我们在血细胞和肠中进行了MjpIgR转录和翻译的时程表达分析。 qPCR结果表明,WSSV攻击后虾的血细胞和肠中的MjpIgR转录从6到24小时上调(图1E和1F)。 MjpIgR蛋白水平也与mRNA水平相似上调(图1G和1H)。 这些结果表明,MjpIgR参与了WSSV感染,其增加的表达促使我们探索MjpIgR在对虾免疫中的详细功能。
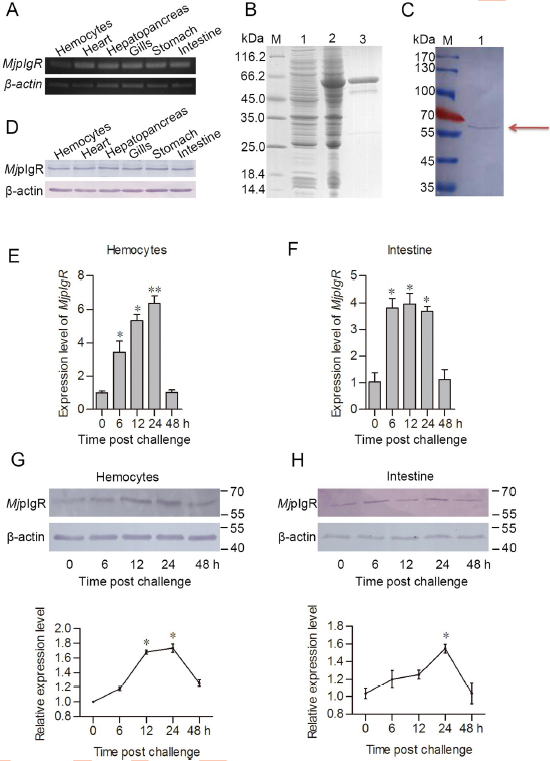
图1 WSSV攻击使虾的MjpIgR表达上调
- MjpIgR促进WSSV的干扰
为了探索MjpIgR在WSSV感染中的功能,进行了RNA干扰,抗体阻断试验和MjpIgR的mRNA过表达。通过qPCR(通过测试vp28表达水平和WSSV拷贝)和蛋白质印迹(使用VP24或VP26作为指标)分析虾中WSSV的增殖。产生了MjpIgR的dsRNA和mRNA(图2A)。在虾中注射dsMjpIgR后二十四小时,观察到MjpIgR在mRNA和蛋白质水平被敲低(图2B和2C)。然后向虾注射WSSV。 dsMjpIgR注射组的血细胞和肠道中的WSSV水平明显低于注射后24小时dsGFP注射组的WSSV水平(图2D)。同时,在MjpIgR-nockdown虾的肠中WSSV的拷贝数明显减少(图2E)。在dsMjpIgR注射组中,与对照组相比,抗VP24抗体检测到的WSSV蛋白水平在血细胞和肠中也降低了(图2F)。注射WSSV后,还通过虾中MjpIgR的RNAi分析虾的存活率。结果表明,与dsGFP组相比,dsMjpIgR注射组的存活率要高得多(图2G)。
此外,抗体阻断试验显示,用MjpIgR免疫的虾中vp28的表达降低,表明抗MjpIgR抗体阻断了血细胞和肠膜上的结合位点(图2H)。 综上所述,这些结果提示MjpIgR促进了虾中WSSV的增殖。为进一步探讨其功能,以Trx-His标签mRNA为对照,通过MjpIgR mRNA注射进行了MjpIgR的过表达。 在mRNA注射后24小时,MjpIgR过表达组的血细胞和肠中成功表达了MjpIgR蛋白(图2I)。 然后用WSSV攻击虾。 与Trx-His标签mRNA组相比,MjpIgR过表达组的WSSV增殖显着增加(图2J)。 通过测试WSSV拷贝数,在肠中获得了相似的结果(图2K)。 抗VP26抗体检测到的WSSV蛋白质水平在血细胞和肠中增加(图2L)。 通常,这些数据表明MjpIgR促进了虾中WSSV的增殖。
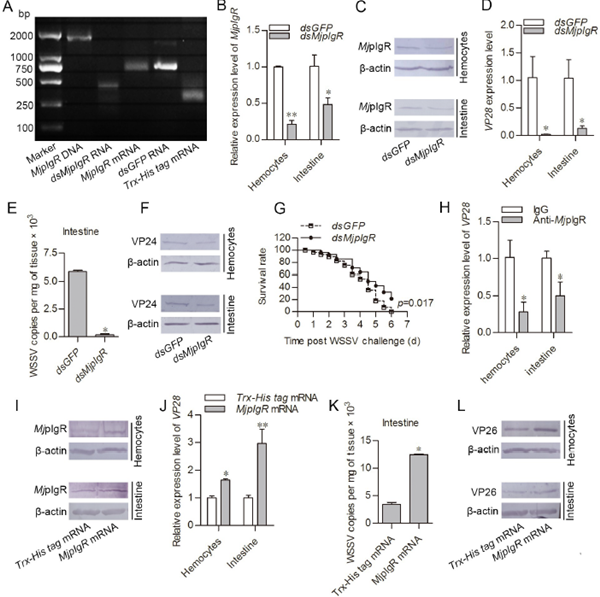
图2 MjpIgR促进WSSV 在虾体内增殖
- WSSV感染后,MjpIgR寡聚为四聚体并被内化到血细胞的细胞质中
为了分析MjpIgR在WSSV增殖中的可能机制,检测了MjpIgR寡聚和内在化。首先使用天然PAGE分析重组MjpIgR(rMjpIgR)的寡聚,结果表明rMjpIgR在体外形成了不同的寡聚体(图3A)。进一步的研究表明,天然MjpIgR形成了四聚体,由WSSV体内攻击后的分子量决定(图3B)。我们进行了免疫细胞化学检测,使用抗MjpIgR抗体检测MjpIgR的亚细胞定位。在正常条件下,MjpIgR主要位于细胞膜上(图3C顶部面板)。 WSSV攻击后,随着攻击时间从15分钟增加到60分钟,MjpIgR逐渐从表面移至细胞质(图3C)。这些结果表明,MjpIgR的内在化可能与WSSV的胞吞作用有关。我们使用蛋白质印迹进一步分析了血细胞膜和细胞质中的MjpIgR。结果表明,随着WSSV攻击时间的增加,血细胞膜中的MjpIgR水平略有下降。然而,其水平在各时间点之间没有显着差异(图3D左图)。WSSV感染后血细胞的细胞质中MjpIgR水平显着增加(图3D右图)。这些结果表明,MjpIgR从膜内化到细胞质中,这种内在化可能与WSSV的内吞作用有关。pbe1突变体幼苗比野生型幼苗对盐和ABA处理更敏感。
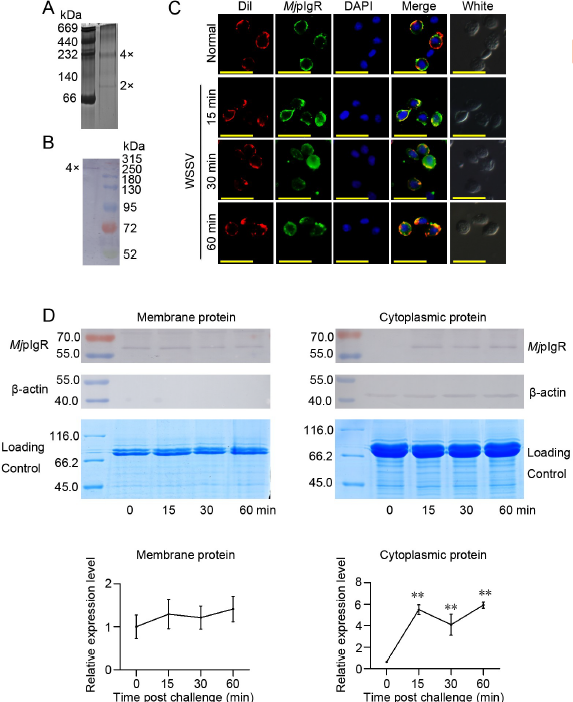
- MjpIgR与WSSV在血细胞中共定位
为了确定WSSV的内吞作用是否需要MjpIgR的内在化,进行了免疫细胞化学分析以检测MjpIgR与WSSV的共定位。在WSSV注射后15分钟观察到MjpIgR与Dil标记的WSSV的共定位(图4A),并且共定位速率从15分钟增加到60分钟,并且WSSV在60分钟时移至核周位置(图4B)。结果表明MjpIgR可能是WSSV的受体,它参与了虾WSSV的胞吞作用。 为了进一步证实结果,在MjpIgR的RNA干扰后进行了流式细胞仪。 结果显示,在MjpIgR的RNAi后,血细胞中WSSV颗粒的内在化速率降低了(图4C和4D)。 这些结果表明,WSSV的内吞作用需要在虾血细胞中内化MjpIgR,而MjpIgR可能是WSSV的受体。
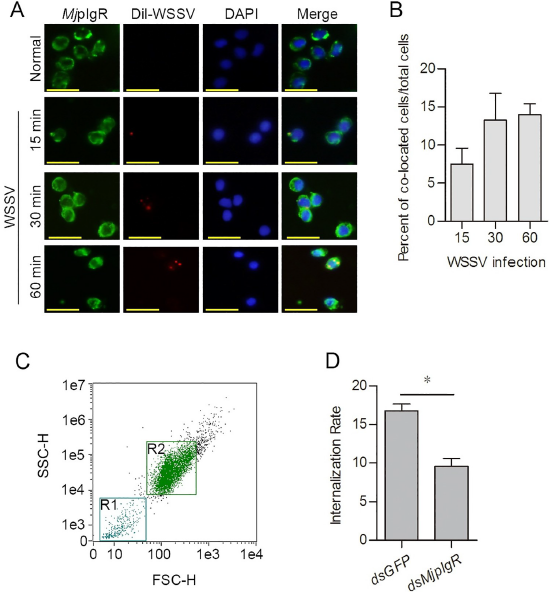
图4 MjpIgR与WSSV在血细胞中共定位。
创新点
在本研究中,我们确定了WSSV进入和感染的关键受体MjpIgR。 MjpIgR的胞外域可与WSSV包膜蛋白VP24相互作用,而胞间域可与MjCaM相互作用。 MjCaM招募了Mjclathrin和AP-2衔接子复合体,这些复合体也与病毒进入有关。因此,WSSV通过pIgRCaM-网格蛋白内吞途径进入宿主细胞。从日本支原体获得的MjpIgR序列具有三个免疫球蛋白结构域,并且是IgSF的成员。作为细胞粘附分子,IgSF是细胞表面或可溶性蛋白质的大蛋白超家族,参与细胞的识别,结合或粘附过程。通过BLAST分析,观察到日本分枝杆菌的IgSF成员与法西林分子,尤其是法西林III相似。但是,通过域结构比较(S1图),我们发现Fasciclin I包含Fas 1(Fascilin样)域,Fasciclin II包含Ig和FN3(纤连蛋白3型)域,而Fasciclin III包含Ig或Ig样域,除了跨膜图案。与聚合免疫球蛋白受体(pIgR)相比,IgSF成员的结构域来自日本分枝杆菌与脊椎动物pIgR非常相似。系统发育分析还表明,日本血吸虫的IgSF成员与脊椎动物的pIgR相似。
因此,我们将来自库鲁玛虾的IgSF命名为pIgR样蛋白(MjpIgR)。在本研究中,携带WSSV颗粒的MjpIgR作为WSSV的受体进入血细胞并引起虾的全身感染。包括pIgR在内的大多数IgSF成员是I型跨膜蛋白,其包含细胞外结构域(包含一个或多个) Ig样结构域),单个跨膜结构域和胞质区域。这些IgSF蛋白可以通过其N端Ig样结构域介导粘附,该结构通常会结合细胞表面上具有相同结构的其他Ig样结构域,或者与其他分子(例如整联蛋白和碳水化合物)相互作用。这表明IgSF分子可以形成均聚物。在我们的研究中,我们发现MjpIgR在体内形成四聚体并与WSSV的VP24相互作用。
几类分子被包括唾液酸部分和整联蛋白在内的各种病毒利用作为受体。特别是,许多IgSF蛋白(例如pIgRs)已被鉴定为病毒受体,例如HIV受体(T细胞表面糖蛋白CD4),主要的鼻病毒受体(细胞内粘附分子-1)以及脊髓灰质炎病毒受体和腺相关病毒病毒受体。在我们的研究中,我们发现MjpIgR与WSSV的VP24相互作用,并且被WSSV用作其进入细胞的受体。
Abbkine专注于免疫学和细胞学领域,致力于创新和研发各类抗体、蛋白质、分析试剂与试剂盒,以期成为生命科学研究发展、药物研发等领域的关键推动者。在这里,我们为您呈献蛋白和免疫研究用户最喜爱的产品,从免疫学基础产品,如蛋白提取定量,到免疫学实验的内参标签抗体、一抗及二抗等;细胞研究用户最喜爱的产品,从用于检测细胞状态的染料及试剂盒,细胞器提取试剂盒,细胞亚结构染色示踪及细胞代谢检测产品,到用于细胞培养的细胞因子及蛋白类检测试剂盒,只为助力您的研究事业!
About Abbkine Scientific Co., Ltd.
Abbkine Scientific Co., Ltd.成立于2012年。我们的使命,通过为全球科学家提供人类和动物健康研究所需的基础研究工具,以期成为研究探索的关键推动者。我们将通过明确的核心战略和促进诚信、开放、合作、创新和为客户服务的企业文化,为全球生命科学研究者提供买得起的高品质产品,实现我们的使命。








