2024年5月10日,来自美国哈佛大学吴皓等研究人员合作在在《免疫》杂志上发表了标题为“Structural transitions enable interleukin-18 maturation and signaling. ”的研究成果,发现结构转变使白细胞介素-18成熟并发出信号。
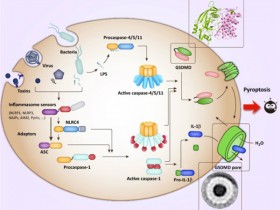
白细胞介素-1 (IL-1)是哺乳动物天然免疫反应中的关键调节因子。以IL-1β 和 IL-18为例,其合成前体(Pro-IL-1β 和 Pro-IL-18)不具有免疫活性。它通常需要炎症性半胱天冬酶(Caspase)切割后才具生物学活性。炎症性半胱天冬酶(Caspase)是哺乳动物天然免疫中的关键酶,它切割Pro-IL-1β 和 Pro-IL-18后,成熟的IL-1通过细胞焦亡 (Pyroptosis)的方式释放,从而介导免疫细胞间的信号传递。但是IL-1前体在被识别之前的状态和识别过程中是否发生构象变化,以及Caspase切割过程如何让IL-1产生免疫活性尚不清楚。
研究发现:
1)Caspase-1识别底物范围更宽,包括Pro-IL-18,Pro-IL-1β, Pro-IL-37 等多种细胞因子; 而Caspase-4识别底物范围较窄,它特异性识别Pro-IL-18而非其他细胞因子(体外活性切割实验验证)。
2)Caspase-1切割底物的活性需要通过其自切割特定位点,才能得以完全释放。
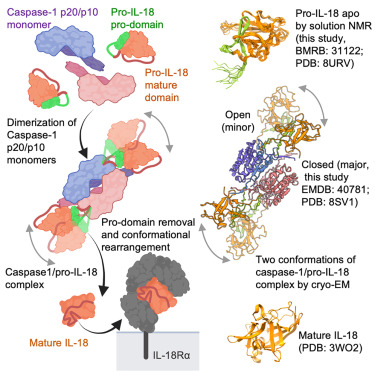
3)Caspase-1/ pro-IL-18复合物的冷冻电镜结构揭示了Caspase-1/ pro-IL-18互作的多种模式。其中主要的两种构象,我们分别命名为开放构象(open conformation)和关闭构象(closed conformation)。关闭构象为主要构象,其包括两个主要作用界面:外部结合位点(Exosite)以及与活性位点(Active Site)这与Caspase-4/ pro-IL-18一致。但是,开放构象中似乎只有活性位点参与了底物识别。
4)接下来我们探索了两个互作界面的功能。对于Caspase-1而言,活性位点主导了pro-IL-18的识别,不依赖于外部结合位点;而Caspase-4识别 pro-IL-18则依赖外部结合位点。
5)研究至此,还没有任何报道关于pro-IL-18被识别之前的构象,于是我们利用溶液核磁共振解析了pro-IL-18在游离状态下的结构,有趣的是该结构与复合物中pro-IL-18的结构高度一致。
6)我们进一步对IL-18被切割前后的结构进行比对分析,发现pro-IL-18转变到IL-18发生了巨大构象变化,而IL-18结合其受体的结合位点只有在被切割后才能构建出来。
研究人员通过冷冻电子显微镜(cryo-EM)揭示了caspase-1与pro-IL-18之间复合物的两种主要构象。一种构象类似于caspase-4和pro-IL-18的复合物,在活性位点和外层(封闭构象)都有相互作用,而另一种构象只在活性位点有相互作用(开放构象)。因此,与caspase-4不同,caspase-1对pro-IL-18的招募和处理对外活性位点的依赖程度较低。
核磁共振结构测定揭示了apo pro-IL-18的紧凑折叠,它与结合了caspase-1的pro-IL-18相似,但与切割的IL-18不同。IL-18受体和IL-18结合蛋白的结合位点只有在pro-IL-18切割后构象发生变化时才会形成。这些研究表明了pro-IL-18是如何被选择为caspase-1底物的,以及为什么其炎症活性需要切割。
研究人员表示,包括IL-1β和IL-18在内的几种IL-1家族成员需要经过炎性体相关caspase的加工才能释放其活性。
文章来源:
Ying Dong, Jeffrey P. Bonin, Pascal Devant et al,Structural transitions enable interleukin-18 maturation and signaling. DOI: 10.1016/j.immuni.2024.04.015,Immunity:最新IF:43.474