hEGF:人表皮生长因子,是人体内的一种多肽激素,由53个氨基酸残基组成,属于类EGF大家族的一个成员,广泛应用于医药和化妆品行业。该多肽不仅可以刺激细胞增殖,分化和迁移,还可以在伤口愈合,器官生成和细胞信号转导中发挥极其重要的作用。它是一种多功能的生长因子,在体内体外都对多种组织细胞有强烈的促分裂作用。
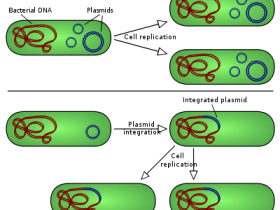
hEGF基因已在各种异源表达系统中成功表达。大肠杆菌是异源蛋白质表达的优选生物之一,被认为是生产商业重组hEGF的最简单和最便宜的表达系统。然而,对于三个分子内二硫键,天然hEGF(没有额外的氨基酸残基)不可能正确折叠并且不易在原核表达系统中可溶性表达。
因此使用各种标签蛋白融合系统,例如6x组氨酸,硫氧还蛋白和谷胱甘肽-S-转移酶,已用于表达和纯化重组hEGF;然而,这些方法在可溶性表达,标签切割和纯化方面不具有高效性。对具有生物活性的hEGF在大肠杆菌中借助信号肽和几种真核系统如Saccharomyces cerevisiae(酿酒酵母),Yarrowia lipolytica(解脂耶氏酵母),和Hansenula polymorpha(多形汉森酵母)的细胞外表达进行了研究,与细胞内表达相比,显著降低了hEGF的产量。
由于对hEGF的浓厚兴趣,研究人员对hEGF生物合成的研究从未停止过。 为了解决上述问题,尤其是低效的可溶性表达,一些研究人员采用了一种有效的SUMO融合策略(该策略已广泛应用于靶蛋白的可溶性表达),以产生和纯化带His标签融合的hEGF。然而,SUMO和基于afnity标签的表达系统需要SUMO蛋白酶在蛋白纯化中切割SUMO标签。添加该蛋白酶不仅成本高,而且还需要额外的步骤以将蛋白酶与纯化的hEGF蛋白分离。
但有文献报道,天然hEGF通过蛋白质融合策略在大肠杆菌中表达为可溶形式,该方法可通过MTT测定鉴定重组hEGF的活性。在该研究中,hEGF基因与内含肽,SUMO和组氨酸亲和标签一起使用以在大肠杆菌中实现可溶性表达,然后进行有效的纯化和活性测定。 将重组质粒hEGF-Mxe-SUMO His10转化到BL21(DE3)中。在20mM DTT诱导的C末端内含肽切割后获得约29.4mg/L生物活性的hEGF。该新方法显著提高了大肠杆菌体内系统中可溶性部分中hEGF的表达水平,使其更易于纯化,并在还原系统中产生含有多个分子内二硫键和天然生物活性的重组hEGF。