1、什么是His-tag?
His-tag单抗又叫6*His-tag单抗,或6*His单克隆抗体,用小鼠制备,His可被镍柱吸附,用于纯化重组蛋白,无论表达的蛋白是可溶的或者包涵体都可以用固定金属离子亲和层析(IMAC)纯化。金属螯合亲合层析,又称固定化金属离子亲合层析(Immobilized metal ion affinity chromatography, IMAC),是近30年发展起来的一种新型分离技术。最早由Paroth等人提出。该方法利用蛋白质表面的一些氨基酸,如组氨酸、色氨酸、半胱氨酸等能和金属离子发生特殊的相互作用的原理,从而对蛋白质加以分离。这些作用包括配价键结合、静电吸附、共价键结合,其中以配价键结合为主,而且这其中又以6组氨酸标签(His-Tag)应用最为广泛。His-tag是蛋白质重组技术中经常用到的一种标签,其序列为6个组氨酸HHHHHH,其特点是分子量小,只有不到0.84 KD,基本不改变蛋白质的生物结构,不改变蛋白质的溶解性,更重要的是它使蛋白质的纯化变得极为方便。根据组氨酸上的咪唑环可以与二价金属离子结合的原理,His-Tag 可结合在目的蛋白的 C 末端或 N 末端,形成特殊的结构,以便于进行下一步的纯化及检测。人们可以利用金属离子亲和层析技术纯化带有His标签的蛋白,即将含有目的蛋白的裂解液通过固定的二价金属离子(通常是二价Ni离子)填料,带有6*his-tag的蛋白质即与填料结合,其它蛋白不与填料结合,最后再用高浓度的咪唑即可将目的蛋白洗脱下来。
以实验小鼠为宿主制备的His-tag单抗叫His-tag鼠单抗。其制备方法通常是这样的:人工合成6*His多肽,即氨基酸序列为HHHHHH的多肽,必要时在末端添加偶联载体用到的特殊氨基酸。合成好此多肽后,通过化学方法将此多肽与载体蛋白偶联(如KLH、BSA、OVA等),偶联完成后,再用偶联好的全抗原免疫实验小鼠,免疫结束后杀死免疫好的小鼠,无菌条件下取脾脏,与骨髓瘤细胞进行融合,用ELISA或者其它手段进行筛选出阳性的克隆,筛选到的细胞经过克隆化后即形成稳定的细胞株,将此细胞株进行体外培养或小鼠体内诱生腹水形成,再从培养基或者腹水中纯化即可得到His-tag鼠单抗,再用Western blot或其它手段进行鉴定即可。
2、His-tag成为蛋白纯化的首选标签的优势:
His-Tag 正逐渐成为分离纯化蛋白质等生物工程产品最有效的技术之一。His-tag单抗可以用来鉴定His-tag的蛋白质的表达情况(如目的蛋白的相对表达量、分子量)、在细胞中的定位以及其它特性。His-tag 作为蛋白纯化时的首选标签,其优势在于:
(1) N-端的 His-Tag 与细菌的转录翻译机制兼容,有利于蛋白表达;
(2)采用 IMAC(固定化金属离子亲合层析)纯化 His-Tag 融合蛋白操作更加简便;
(3)His-Tag 对目的蛋白本身特性几乎没有影响,不会改变目的蛋白本身的可溶性和生物学功能;
(4)His-Tag非常小,一般不影响蛋白质的功能,且在融合蛋白结晶后对蛋白的结构没有影响;
(5)His-Tag 的免疫原性相对较低,可将纯化的蛋白直接注射入动物体内进行免疫并制备抗体;
(6)与其它亲和标签构建成双亲和标签,并可应用于多种表达系统,纯化的条件温和;His-Tag 融合蛋白的适用范围也较广,既可以在非离子型表面活性剂存在的条件下纯化,也可以在变性条件下进行纯化。前者通常用来纯化疏水性强的目的蛋白,而后者则通常纯化包涵体蛋白。(His-tag:His组氨酸标签融合蛋白纯化精品)
3、His-tag蛋白纯化原理:
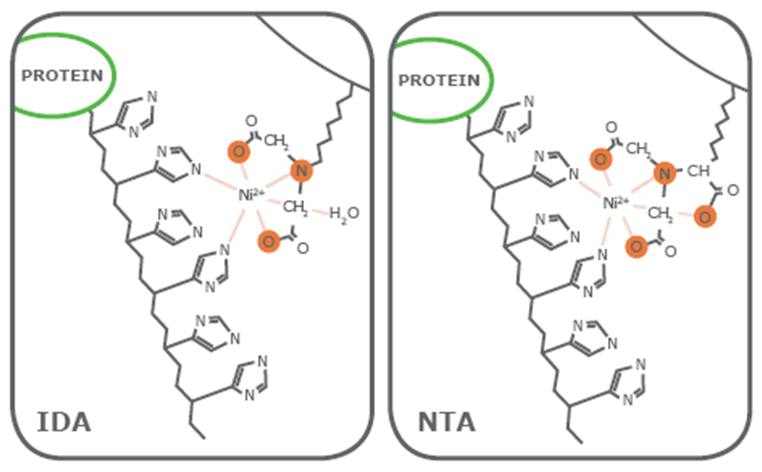
His-Tag可与多种金属离子发生特殊的相互作用,如 Ca2+、Mg2+、Ni2+、Cu2+,Fe3+等,其原理是利用蛋白质表面的特性,使之被吸附在凝胶柱上,从而达到分离纯化蛋白的目的。组氨酸(His)的残基上带有1个咪唑基团,可以和Ni2+、Co2+等过渡金属离子形成配位键而选择性的结合在金属离子上,这些金属离子能够用鳌合配体固定在层析介质上,因此带有His-Tag的蛋白在经过装配了金属离子的层析介质时可以选择性的结合在介质上,而其他的杂质蛋白则不能结合或仅能微弱结合。结合在介质上的His-Tag蛋白可以通过提高缓冲液中的咪唑浓度进行竞争性洗脱,从而得到较高纯度的 His-Tag蛋白。在亲和纯化实验中的使用最为广泛的是Ni2+。根据结合基团的不同,Ni2+亲和层析柱可分为两类:一类是Ni-IDA,另一类是Ni-NTA。Ni2+有六个螯合价位,其中Ni-IDA 螯合了三价,Ni-NTA 螯合了四价。所以IDA 的载量要比NTA 的高,在同样条件下,Ni-IDA 洗脱时所需的咪唑浓度也高于Ni-NTA。但其弱的结合力使金属离子在洗脱阶段时很容易浸出,与目的蛋白紧密结合,从而导致分离蛋白产量偏低,产品不纯及金属离子污染等问题。NTA的颗粒粒度均匀,粒径更小,并且螯合镍更稳定,能耐受较高的还原剂,使填料更加稳定,镍离子不易脱落,因此选择Ni-NTA亲和层析柱进行蛋白纯化。(His-tag:His组氨酸标签融合蛋白纯化精品)