一、背景
组蛋白H2AX在tyr142位点的磷酸化可以参与包括DNA修复在内的多种生物进程。Ras通路与人类癌症密切相关。我们的研究通过调节H2AX.Y142ph来研究Ras通路的作用。
1)方法
用Ras转染胃癌细胞系SNU-16和MKN1细胞,进行G12D和T35S位点突变,通过WB实验检测到H2A.XY142 and ERK1/2, WSTF和MDM2 的磷酸化,分别用MTT法、软琼脂菌落形成法和Transwell法测定细胞活力、细胞集落和迁移率。通过qRT-PCR检测Ras通路相关下游因子EYA3和WSTF的表达。通过ChIP检测Ras与下游因子的关系。流式细胞术检测细胞周期进展。
2)结果
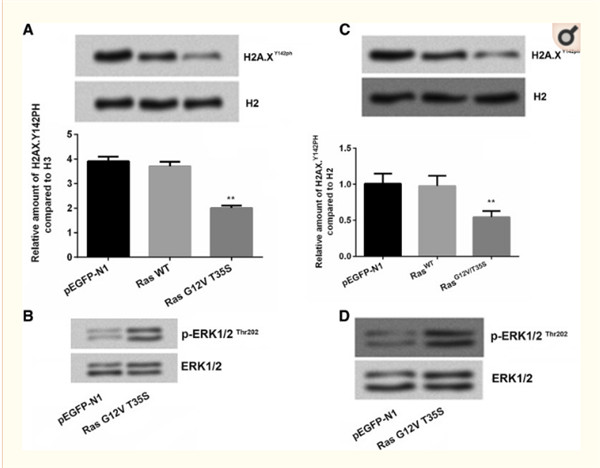
RasG12D/T35V 的横切能降低H2A.XY142 的磷酸化以及ERK-1/2. H2A.XY142 抑制细胞活力的活性磷酸化,增殖和迁移。H2A.XY142ph 会改变Ras 下游因子的表达。 CHIP 实验表示t RasG12D/T35V 可以与这些Ras通路下游因子的启动子结合。另外, EYA3的沉默也能改变下游因子的表达。 WSTF 和H2A.XY142ph 也揭露了相同的趋势,然后MDM2呈现相反的趋势。
3)结论
Ras/ERK 信号通路会降低H2A.XY142ph 和促进细胞生长和代谢,这个Ras调节过程通过MDM2-WSTF-EYA3的级联下调 H2A.XY142ph细胞中的XY142ph
二、实验过程
组蛋白修饰影响细胞生长和转移。在本研究中,我们构建了H2A.XY142A 质粒模拟H2A.XY142A 的磷酸化情况。见图表实验。
三、结论
表观遗传修饰的改变可能是胃癌等恶性肿瘤发生发展的重要原因之一。表观遗传修饰包括多种形式,如DNA上胞嘧啶的甲基化和组蛋白的n端(H2A、H2B、H3和H4)。重要的是,由于组蛋白的乙酰化、甲基化、磷酸化和泛素化是引起异常基因损伤的主要原因,因此组蛋白修饰在世界范围内备受关注。另一方面,众所周知,Ras通路涉及多种人类癌症,如大肠癌。重要的是,Ras/ERK是调控GC中细胞增殖和侵袭的有效途径。
细胞活力、细胞集落和细胞迁移是判断细胞生长和转移的三个重要因素。Ras/ERK信号通路常被发现在多种人类癌症中被激活,与此同时,组蛋白修饰在癌症的进展中起着至关重要的作用。例如,胰腺癌细胞的生长和转移被P27、P53和Bax的组蛋白修饰调控。因此,我们推断H2A的组蛋白修饰。H2A.XY142ph可能通过调控下游相关基因影响细胞生长。