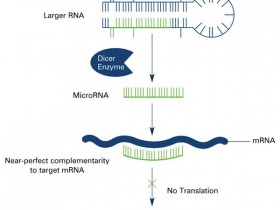
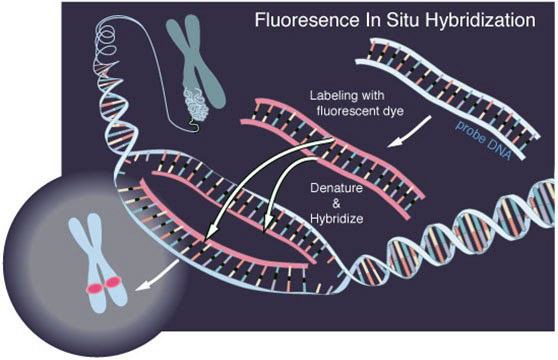
我们通常使用荧光原位杂交(FISH)技术检测组织中的DNA或RNA序列,那他能不能检测microRNAs呢?提到miRNAs,我们首先想到的是他们非常小,确实它们是很短的单链RNA分子,只有18-23个核苷酸。由于他们很小,所以对FISH技术的可行性有很多担忧,比如探针能否具有足够的敏感性和特异性,什么样的探测系统适合于来自这些短的目标序列的信号等等。
miRNAs在FFPE组织中的完整性
很有趣的是,研究表明相比于mRNAs, miRNAs在福尔马林固定的石蜡包埋组织(FFPE)中能够更好地保存。正是因为他们的体积小, 可以和大的蛋白复合物紧密结合,使得它们能够忍受这个过程。不过,需要一直保持没有RNAse污染的环境,经常我们会使用DEPC水来准备溶液。当然,实验需要的任何器具都需要提前进行高压灭菌。
抗原修复
经过福尔马林固定交联会限制探针和试剂,使它们不能接近目的miRNAs,可以用抗原修复术来暴露这些位点。大多数protocols会使用含有蛋白酶K的 tris缓冲液中来打破甲醛交联,也有一些报告,蛋白酶K可能会破坏一些抗原表位,建议在柠檬酸缓冲中加热样本。这两种方法都会有效, 可以探索哪种更适合自己的样本。
探针选择
曾经有人探索使用地高辛标记的核酸探针进行miRNAs的FISH实验,但由于目标序列太短,双链稳定性差,而且与紧邻的相关miRNAs有很高的序列相似性,使得很难达到足够的特异性。现在我们通常使用表现更好的Locked DNA(LNA)探针来实现这一过程。
Locked DNA是一类DNA类似物,糖环上被锁定在一个亚甲基桥,使得探针在N构象稳定,因此LNA探针是结合的最佳选择, 它们在更高的温度下实现更高的亲和力和稳定性。完全匹配的双链和错配之间所需温度不同,所以更容易找到一个杂交温度可以只检测的完美匹配
而且,LNA/miRNA杂交体可以抵抗核酸酶的攻击。
对照探针
确保使用阳性和阴性对照探针,特别是设置程序时。阳性对照是检测存在于特定组织中的miRNA,阴性对照设置两个探针,其中一个含有两处错配,另一个是针对你所要检测的组织中已知的不会表达的miRNA具有特异性。如果你难以区分背景噪音的信号,你应该还设置一个‘no probe’对照.
杂交和洗涤
最好是先在50°C进行两个小时的预杂交,然后再与探针进行杂交过夜,温度也是在50°C. 之后进行严格的洗涤步骤,这是去除非特异性反应的关键步骤。洗涤是在SSC缓冲液中,先是在37°C进行洗涤, 以去除多余的探针和杂交缓冲液,然后在50°C进行振荡洗涤,以消除非特异性和重复性的杂交。如果非特异性结合仍然是一个问题,试着重复洗几次。如果你刚刚开始实验,可以探索下不同的杂交和洗涤温度,可能上下两度的的差异会带来很大的不同。
探针标记和信号检测
市场上有很多种寡核苷酸标记示踪剂以供选择。生物素被用作5’端耦合,适合进行免疫组化检测。如果你的组织是丰富的内源性生物素,dioxigenin应该是你的第一选择。结合anti-label抗体后,用辣根过氧化物酶系统将信号放大。还可以选择一个合适的荧光基团为HRP底物,最常使用的是花青染料, Alexa系列或Quasar染料也是一种选择。根据所需的ex/em,双标等选择合适的标记。
用FISH技术检测FFPE组织中miRNAs有很多优势,可以使miRNAs在复杂组织中的确定位置形象化地体现,可以进行大量样本的检测。随着科学发展,还可以同时检测蛋白质标记的miRNA,以及多元miRNA FISH技术。无论在癌症领域还是发育生物学领域,miRNA研究都是具有无限潜力的!