2024年8月23日,来自复旦大学王磊等研究人员合作在《科学》杂志上发表了标题为“Mechanisms of minor pole–mediated spindle bipolarization in human oocytes.”的研究成果,揭示人类卵母细胞中小极体介导的纺锤体双极化机制。
全球有6000万-8000万对夫妇面临不孕之苦,有数百万人进行试管婴儿治疗,但临床中时常遇到卵子、授精及胚胎发育异常的情况,人们对这些异常背后的原因及机制所知甚少。
研究人员表示,纺锤体双极化是指微管质转变为双极纺锤体的过程,这是精确染色体分离的前提。与有丝分裂细胞不同,人类卵母细胞中纺锤体双极化的过程和机制仍不清楚。
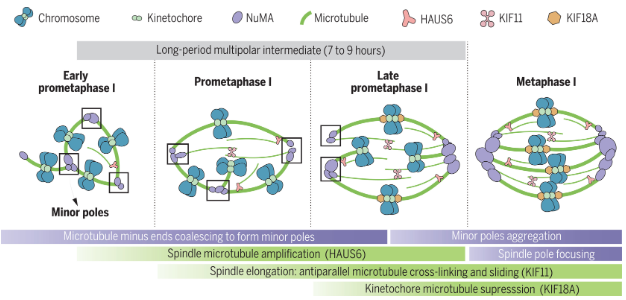
通过在超过1800个人类卵母细胞中进行高分辨率成像,团队通过免疫荧光和活细胞时间序列成像技术,首次对减数分裂开始后纺锤体的组装过程进行了高清晰度的实时观察。结果显示,人卵母细胞核膜破裂之后,染色体动粒会相聚成簇。随后,新生微管负端在动粒附近聚合并初步形成纺锤体的极,将其命名为“小极(Minor pole)”。研究人员揭示了在纺锤体双极化过程中形成的多极中间体的典型状态,并阐明了这一过程的机制。研究人员发现,多极中间体的生成与多个动粒簇中形成的小极体有关。
在第一次减数分裂前中期,多个“小极”组装形成典型的“多极纺锤体”,多极纺锤体状态持续长达7-9个小时。在此期间,小极的数目逐渐增多并聚集,直到第一次减数分裂中期形成两个“大极(Major pole)”,最终完成纺锤体双极化过程-多极纺锤体转变为双极纺锤体。“以上过程与有丝分裂及其他哺乳动物卵母细胞的纺锤体双极化过程截然不同,进一步展现出人卵纺锤体组装的独特机制。”
研究人员进一步确定了HAUS6、KIF11和KIF18A在纺锤体双极化中的关键作用,并在卵母细胞或胚胎缺陷的不育患者中发现了这些基因的突变。这些结果为人类卵母细胞中纺锤体双极化的生理和病理机制提供了新见解。
文章来源:
Tianyu Wu, Yuxi Luo, Meiling Zhang, Biaobang Chen et al, Mechanisms of minor pole–mediated spindle bipolarization in human oocytes. DOI: 10.1126/science.ado1022, Science:最新IF:63.714







