2024年8月21日,来自中国科学院物理研究所姜道华团队在《自然》杂志上发表了标题为“Human XPR1 structures reveal phosphate export mechanism.”的研究成果,通过研究人类XPR1结构揭示了磷酸盐输出机制。
据介绍,无机磷酸盐(Pi)是所有生物体的基本常量营养素,其稳态对许多生物活动至关重要。作为迄今为止唯一已知的人类Pi输出者,XPR1是目前人体中唯一已知的磷酸盐外排转运蛋白,XPR1在细胞Pi稳态中起着不可或缺的作用。XPR1的功能障碍与神经退行性疾病有关。然而,XPR1介导的Pi外排和细胞内肌醇多磷酸盐(InsPP)传感器SPX结构域调节的机制仍然知之甚少。
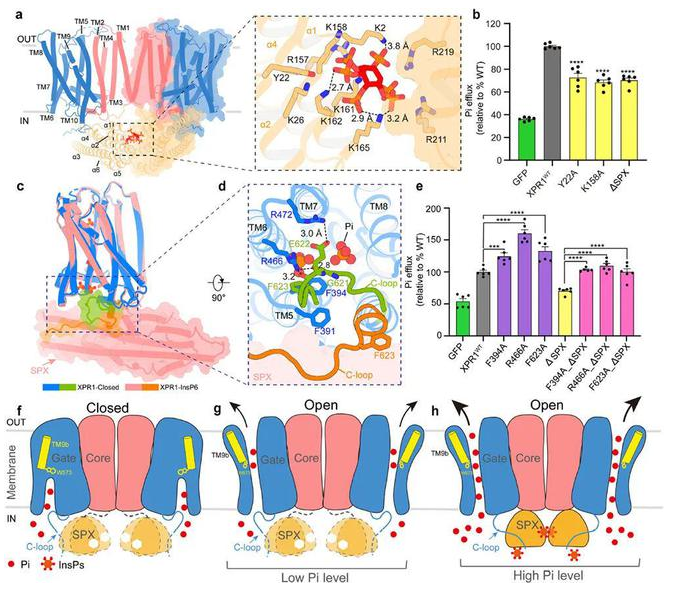
在这项研究中,作者解析了XPR1处于关闭,开放和结合肌醇-6磷酸的三种不同构象,首次发现XPR1二聚体形式。基于结构和功能结果,作者提出了XPR1门控机制和SPX结构域的调控机制模型。XPR1门控机制主要由TM9b的构象变化介导,磷酸根被靠近细胞内内侧的位点一和位于细胞膜中间的位点二识别和结合,通过与W573相互作用,进而引发TM9b构象变化,使XPR1处于打开状态。
XPR1磷酸盐转运调节机制模型
而SPX结构域可以通过感受细胞内磷酸肌醇的浓度来调控XPR1外排磷酸根离子的通量:当细胞内磷酸根浓度较低时,多磷酸肌醇浓度降低,SPX结构域呈动态构象,XPR1的C-loop结合在位点一附近并降低限制磷酸根进入蛋白磷酸根入口;当细胞内磷酸根浓度升高时,多磷酸肌醇浓度升高,SPX结构域结合多磷酸肌醇并转换为稳定构象,稳定状态的SPX结构域与C-loop相互作用,使其远离磷酸根入口,从而加速Pi的外排。由于磷酸根结合位点,TM9和C-loop,以及SPX结构域在酵母SYG1,植物PHO1和其他动物中的XPR1中高度保守,因此,作者推测这些蛋白应该采用类似的机制来维持Pi的稳态。
研究人员以Pi结合的闭合、开放和InsP6结合形式展示了人类XPR1的冷冻电镜结构,揭示了XPR1门控和InsPP调控的结构基础。XPR1由N端SPX结构域、二聚体形成核心结构域和Pi转运结构域组成。在运输结构域内,三个基本簇负责Pi的结合和运输,保守的W573充当门控的分子开关。
此外,SPX结构域与InsP6结合,并通过释放限制Pi进入的C末端环来促进Pi流出。
总之,这一研究为真菌、植物和动物中XPR1同源物对Pi稳态的机制理解提供了一个概念框架。
文章来源:
Yan, Rui, Chen, Huiwen, Liu, Chuanyu, Zhao, Jun et al,Human XPR1 structures reveal phosphate export mechanism.DOI: 10.1038/s41586-024-07852-9,Nature:最新IF:69.504







