1、Nature:人T细胞受体-共受体复合物组装的结构基础
近日,来自哈工大学的黄志伟团队在《Nature》上在线发表了题为“Structural basis of assembly of the human TCR-CD3 complex”的研究文章,该研究首次解析了人T细胞受体-共受体(TCR-CD3)复合物(包含全部8个亚基)的高分辨率冷冻电镜结构,通过对结构分析,揭示了TCR和CD3亚基在膜外侧以及膜内识别、组装成功能复合物的分子机制,从而回答了免疫领域关于T细胞受体结构的基础科学问题,而且对解析T细胞活化的分子机制具有重要的科学意义,同时也为开发基于T细胞受体的免疫疗法提供关键结构基础。
人们对TCR胞外可变区如何识别各种抗原进行了很深入的研究,但作为细胞免疫基础科学问题之一的TCR-CD3复合物组装以及信号转导的结构基础仍然未知。
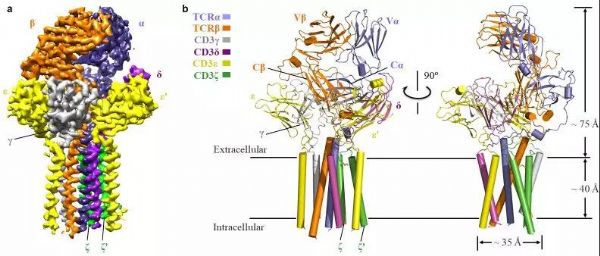
图 来源Nature | TCR-CD3复合物的整体结构图
本研究中首先对不同人的细胞库进行筛选确定研究的目标TCR复合物,接着寻找到合适的化学交联剂用于纯化蛋白复合物样品,接着通过冷冻电镜解析了第一个来源于人的TCRα/β-CD3复合物的3.7 ?的高分辨率结构(图一)。该TCR-CD3复合物结构包含完整的胞外结构域(ECD)以及所有跨膜区域。该TCR-CD3复合物结构显示其由1:1:1:1的TCRα/β:CD3γ/ε:CD3δ/ε’:CD3ζ/ζ’八聚体亚基组装形成,这与之前的生化研究结果一致。TCR-CD3复合物的胞外区域由TCRα/β的恒定区以及连接胞外和膜内的连接肽结合CD3的γ/ε和δ/ε’两个二聚体模块组装而成,TCR-CD3复合物胞外区域的组装在接近细胞膜的外侧形成类三次对称的结构,TCRβ亚基的恒定区位于该三次对称结构的中心位置。CD3膜内部分由ζ/ζ’亚基的两个跨膜螺旋和γ/ε以及δ/ε’亚基的跨膜螺旋结合形成桶状构象。
TCR-CD3复合物膜内组装由TCRα/β的两个跨膜螺旋通过疏水和电荷作用插入CD3筒状跨膜结构中形成(图二)。所以,TCR-CD3各亚基近膜侧的连接肽以及膜内区域的强相互作用对整个复合物的组装起着关键作用。有趣的是,将该复合物结构与结合有pMHC的TCRα/β胞外的区域结构比较发现pMHC的结合并没有引起TCRα/β结构的明显变化。
(中国科学院院士施一公教授评价:T细胞受体复合物结构之谜一直是世界顶级科学家们梦想解决的细胞适应性免疫学的重要科学问题,哈工大黄志伟团队对该复合物结构的解析是理解细胞适应性免疫机制的重要里程碑。)
文章来源:De Dong, Lvqin Zheng, Jianquan Lin,et al. Structural basis of assembly of the human TCR–CD3 complex. Nature (2019).
2、Nature :STAT3棕榈酰化促进肿瘤进展
近日,来自哈佛学院的Jixiao Niu等研究人员在《Nature》上发表了题为“Fatty acids and cancer-amplified ZDHHC19 promote STAT3 activation through S-palmitoylation”的研究论文。发现STAT3的SH2结构域在翻译后发生S-棕榈酰化(S-palmitoylated),这促进STAT3的二聚化和转录激活。在细胞因子刺激的协同作用下,脂肪酸通过增加STAT3的棕榈酰化直接激活这种蛋白。
蛋白STAT3(signal transducer and activator of transcription 3)在调节细胞命运、炎症和免疫方面具有重要作用。细胞因子和生长因子通过激酶介导的酪氨酸磷酸化和二聚化来激活STAT3。科学家们目前尚不清楚其他因子是否通过不同机制促进STAT3激活。
这些研究人员进一步鉴定出ZDHHC19是一种调节STAT3的棕榈酰酰基转移酶。细胞因子刺激通过促进ZDHHC19和STAT3之间的结合来增加STAT3棕榈酰化,这是由GRB2的SH3结构域介导的。沉默ZDHHC19可阻断STAT3棕榈酰化和二聚化,并破坏细胞因子和脂肪酸诱导的STAT3激活。
ZDHHC19经常在多种人类癌症中扩增,包括39%的肺鳞状细胞癌。高水平的ZDHHC19与患者样品中高水平的细胞核STAT3相关。此外,敲除肺鳞状细胞癌细胞中的ZDHHC19显著阻断STAT3活性,抑制脂肪酸诱导的肿瘤球形成,以及在体内小鼠模型中抑制由高脂肪饮食诱导的肿瘤发生。
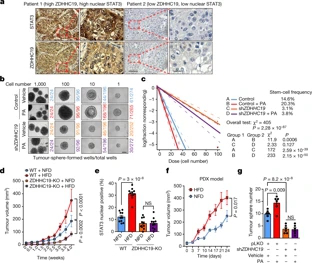
图 来源Nature
由此可见,这些研究结果表明脂肪酸和ZDHHC19介导的棕榈酰化是调节STAT3的信号,这提供了将棕榈酰化失调与炎症和癌症相关联在一起的证据。
就在这篇文章在Nature期刊上在线发表一天后,就有人提出这篇文章中的多处存在重复使用图片的嫌疑。针对质疑,相关调查已启动。因此,针对最终的结果,让我们拭目以待吧。
(评论:发布第二天就背上学术不端的嫌疑,也是。。。。。)
文章来源:Jixiao Niu et al. Fatty acids and cancer-amplified ZDHHC19 promote STAT3 activation through S-palmitoylation. Nature, 2019, doi:10.1038/s41586-019-1511-x.
3、Nature:利用热点热分析发现功能蛋白修饰的高通量
近日,来自美国芝加哥大学Raymond E. Moellering及其研究团队在Nature上发表了题为“High throughput discovery of functional protein modifications by Hotspot Thermal Profiling”的研究论文,研究人员利用热点热分析方法实现对功能性蛋白的高空量挖掘。
研究人员开发了一个名为热点热分析(Hotspot Thermal Profiling)的蛋白质组学方法,可以检测位点特异性蛋白质磷酸化对活细胞中数千种天然蛋白质的热稳定性的影响。这种大规模平行的生物物理分析揭示了响应于位点特异性磷酸化位点的整体蛋白质稳定性的变化,以及与蛋白质功能和结构相关的趋势。该方法可以检测蛋白质结构的内在变化以及由磷酸化引起的蛋白质—蛋白质和蛋白质—代谢物相互作用的外在变化。
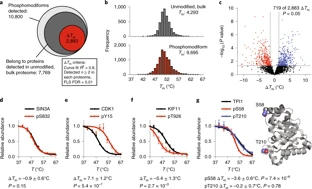
最后,研究人员发现,通过这个方法,功能性“热点”蛋白质修饰位点能够被鉴定出来,并以高通量和无偏倚的方式优先进行研究。该方法适用于不同的生物、细胞类型和翻译后修饰。
据悉,质谱能够对来自生物样品的翻译后修饰的蛋白质进行全局分析,但科学家仍然缺乏能够系统性预测或优先考虑哪些修饰位点可能扰乱蛋白质功能的方法。
(评论:鉴定蛋白质功能性修饰的新方法。)
文章来源:Jun X. Huang et al. High throughput discovery of functional protein modifications by Hotspot Thermal Profiling. Nature, 2019, DOI: 10.1038/s41592-019-0499-3







