随着生活水平的提高,我国肥胖特别是青少年肥胖人数不断增多,肥胖已经成为一个严重的社会问题。那么人为什么会肥胖呢?如果不是因为一些疾病原因,从最简单的道理上讲,肥胖是人体能量摄入和消耗失衡的结果,即能量摄入大于能量消耗,结果造成能量在体内以脂肪的形式储存下来,经过一段时间后体重明显增加形成肥胖。
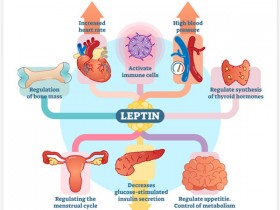
人体内有一种调控食欲和脂肪储存的重要激素-廋素。瘦素是由脂肪组织分泌的一种激素,通过和其受体结合可以激活相应的神经元,向大脑传达一种“我吃饱了”的信号,从而抑制食欲,还可以增加能量消耗,减少脂肪的合成和储存。“瘦素抵抗”是人类肥胖的一个显著特征。研究早就发现,胃饥饿素和瘦素这两种激素对食欲和体重管理起着重要作用,胃饥饿素告诉你什么时候饿了,瘦素则在你吃饱时通知大脑可以停止进食。多年来,科学家认为肥胖是因为人体缺少瘦素,使得大脑无法及时获知吃饱的信息,引起过度进食。但近来越来越多的研究显示,肥胖人群体内瘦素充足,而且比正常人更多,因此他们更可能是出现了“瘦素抵抗”,也就是说,大脑不再把瘦素当作吃饱的信号,反而认为是饥饿。如果产生“瘦素抵抗”了,人们会食欲旺盛地大量进食,刺激胰岛素大量释放,血中高水平的胰岛素会将摄入过多的营养,合成脂肪给贮存起来,人就胖起来了。而长期进食高脂、高糖、高蛋白的食物,导致代谢紊乱,就会造成“高胰岛素血症”。

“瘦素抵抗”的原理
为什么会出现“瘦素抵抗”呢?其实,这与长期高脂、高糖、高蛋白饮食有关。人的下丘脑有控制食欲的神经中枢,即饱腹中枢和摄食中枢。其传令官分别是葡萄糖和游离脂肪酸。
吃饭时,血中的葡萄糖增多,刺激饱腹中枢,让人产生饱腹感,就不想再吃了;饭后,血中葡萄糖减少,机体分解脂肪来供应能量,血中游离脂肪酸增多,刺激摄食中枢,让人产生了饥饿感。如果一个人长期高脂、高糖、高蛋白地饮食,会导致高脂血症,血中游离脂肪酸水平升高,持续刺激摄食中枢,让人总感到饥饿。由于游离脂肪酸的刺激,让中枢指挥系统无法接收到瘦素传来的“能量已超标”的信息,这样就“瘦素抵抗”了。由于瘦素的信号通路被破坏,大脑并不能够接收到“吃饱了”的信号,反而一直喊“饿”,越胖吃得越多!那么,高脂、高糖、高蛋白地饮食到底是如何破坏廋素信号通路的呢?
MMP-2切割廋素受体导致“瘦素抵抗”
最近,来自加利福尼亚大学圣地亚哥分校的Geert W. Schmid-Schönbein教授为我们揭示了高脂饮食破坏瘦素信号通路的这一“阴谋”-原来高脂饮食会诱导下丘脑内神经元产生更多的基质金属蛋白酶-2(MMP-2),而这种酶会切割人体内的瘦素受体,破坏瘦素的信号通路,让人一胖不可收拾!只要抑制MMP-2,瘦素受体就可以正常表达,血清中的瘦素水平恢复正常,被喂了高脂饮食的小鼠体重增加明显减少。这篇文章发表在《科学转化医学》上。

Geert W. Schmid-Schönbein教授
啥?通过切割瘦素受体来阻碍瘦素的信号通路?MMP-2真是用心险恶,太歹毒了!那么,这个“阴谋”是怎样被研究人员发现的呢?
研究人员用12周的高脂饮食诱导了小鼠的肥胖,眼睁睁的瞅着它们越吃越胖,越胖越爱吃,哪怕血清瘦素水平一直居高不下,也不能控制住它们的体重和吃东西的欲望。由于瘦素的主要作用区域在中枢神经系统,研究人员干脆对实验小鼠大脑的总蛋白酶活性做了测定,结果发现,有一位MMP-2同志非常突出,它的活性是对照组的2.5倍!咋会升高这么多?

MMP-2活性升高
怀疑的目光自然就落在了MMP-2的身上。MMP-2是神马东东?MMP-2是一种蛋白水解酶,能够降解多种细胞外基质,在生理生化过程中起着重要的作用。细胞外基质不就是分布在细胞外或细胞表面的一些大分子多糖和蛋白么?好像就包括一些激素的受体吧?研究人员赶紧检查了一下瘦素受体是否安好。答案是:高脂饮食小鼠的瘦素受体比对照组少了将近一半。
不过,只是MMP-2水平升高和瘦素受体水平减少两个现象,也不能说明就是MMP-2降解了瘦素受体。接下来,研究人员十分仔细地分析了瘦素受体的结构,在其中发现了MMP-2的识别位点,并且,还在下丘脑细胞中检测到了瘦素受体被剪切后的片段,断裂处和MMP-2的识别位点相吻合!这下抓到现行了,就是MMP-2降解了瘦素受体!
为了验证MMP-2耗尽对高脂饮食诱导肥胖的影响,研究人员构建了MMP-2缺陷的小鼠模型,以野生型小鼠为对照,同样喂以高脂饮食。结果不出所料,缺陷型小鼠的体型较小,体重增加较慢,饭量也比野生型的小鼠要小。更重要的是,即使在高脂饮食下,缺陷型小鼠的瘦素受体也保持在了较好的水平,是高脂饮食野生型小鼠的近两倍,只比正常饮食的野生型小鼠低了一点点。

MMP-2缺陷型小鼠(灰)比野生型(黑)苗条不少哇
当然了,现在的技术还不足以敲除一个人的MMP-2基因,所以研究人员退而求其次,用RNA干扰技术(参见《浅谈miRNA与siRNA和shRNA的关系》一文,RNA干涉(RNAi)在实验室中是一种强大的实验工具,两个在RNAi途径的基因沉默中具有实质利害关系的是双链小干扰RNA(siRNA)和基于载体的短发夹RNA(shRNA)。)设计了可以沉默MMP-2的发夹RNA,输送到MMP-2表达的“重灾区”-下丘脑中,然后又喂了小鼠12周的高脂饮食。果不其然,与对照组相比,小鼠的瘦素受体水平有所回升,体重增加大大减少,血清中“虚高”的瘦素水平也有了回落。最后,研究人员还找到了被高脂饮食诱导分泌MMP-2的源头,就是下丘脑中的星形胶质细胞和AgRP神经元。
研究人员表示,他们下一步想要找出为什么高脂饮食可以诱导MMP-2活性的增加,并且设计一种抑制剂来抑制MMP-2的活性或者MMP-2的激活途径,来真正为人们减肥提供帮助。当然,大规模的临床试验也是少不了的。“为了更好的了解瘦素受体降解和高脂饮食引起的瘦素功能丧失,我们仍有许多工作要做。”
抑制RAP1基因可改善“瘦素抵抗”
在以往的研究中,RAP1基因一直被认为与代谢、体重增加,以及暴饮暴食有关。不过,科学家们一直无法确定它们之间的确切联系。根据《每日邮报》近日的报道,美国贝勒儿童医学院和NIH等研究单位的科学家们成功地通过一种药物,抑制了实验室中老鼠的肥胖基因-RAP1基因,阻止了他们暴饮暴食,在进行了高脂饮食喂养以后并未出现“瘦素抵抗”。这一发现被喻为在减肥研究中的一个突破。
为了探索RAP1基因在小鼠实验中的作用,科学家们有选择性地敲除了一组实验小鼠的RAP1基因,该基因位于下丘脑的一组神经元细胞中,这是参与调节全身代谢的大脑区域。
有两组实验小鼠。一组实验小鼠被敲除了RAP1基因,而对照组保留有RAP1基因。接着,科学家将同样的高脂肪饮食喂给两组实验小鼠吃,这些饮食中60%的卡路里来自脂肪。正如预期的那样,具有正常RAP1基因的小鼠体重增加了。比较而言,被敲除RAP1基因的小鼠体重显著下降,同时体脂也有所降低。但是,当两组小鼠被饲喂以正常饮食的时候,它们的体重和体脂含量却类似。“我们观察到,被敲除RAP1基因的小鼠虽然活动度没有改变,但进食量减少同时对脂肪的消耗更多。”文章作者Makoto Fukuda这样说道,“这些现象与下丘脑分泌的POMC增加和NPY以及AgRP减少有关,这些激素都参与食欲的调节。除此之外,被敲除RAP1基因的小鼠血糖和胰岛素水平也低于对照小鼠。”
科学家们还对缺乏RAP1基因的小鼠是否出现瘦素改变产生了兴趣。研究者发现缺失RAP1基因的小鼠在进行了高脂饮食喂养以后并未出现“瘦素抵抗”,它们仍然能够对瘦素产生应答!
Fukuda和他的同事还测试了用抑制剂ESI-05这种药物来抑制RAP1基因来处理肥胖小鼠,其结果发现药物处理能够恢复小鼠对瘦素的敏感性,将血液中瘦素的水平降低到正常饮食小鼠的水平,受到药物处理的小鼠会吃得更少,体重也会随着下降。什么?科学家们已经成功地使用药物来抑制小鼠的脂肪基因?这项新的研究成果点燃了人类对于神奇减肥药片的希望。
研究人员最后表示,该研究发现高脂饮食会增加小鼠脑部RAP1的活性,导致对瘦素的敏感性下降从而发生肥胖。脑部RAP1参与的这条新机制可能代表了一个潜在的治疗靶点,未来有望用于人类肥胖的治疗。