2024年8月21日,来自德国马克斯·普朗克生物化学研究所F. Ulrich Hartl、Wolfgang Baumeister和德国哥廷根大学医学中心Ruben Fernandez-Busnadiego课题组合作在国际学术期刊《自然》杂志发表了标题为“Visualizing chaperonin function in situ by cryo-electron tomography.”的研究成果,通过低温电子断层扫描揭示了伴侣蛋白的原位功能。
据悉,伴侣蛋白是一种大型桶状复合物,可介导ATP依赖的蛋白质折叠。细菌伴侣蛋白GroEL形成并列的环,在其开口处结合未折叠蛋白质和盖状辅助因子GroES。伴侣蛋白反应的体外分析表明,当底物蛋白质被GroE暂时包裹在GroEL中心空腔时,底物蛋白质不受聚集影响而折叠。
GroEL-GroES辅助蛋白质体内折叠的机制
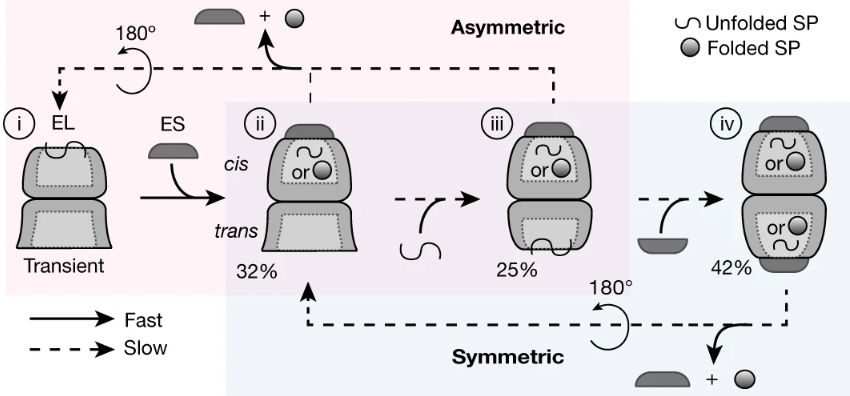
为了确定GroEL、GroES和底物蛋白的原位功能配比,研究人员使用低温电子断层扫描技术观察了伴侣蛋白复合物在自然细胞环境中的情况。研究发现,在不同的生长条件下,约55-70%的GroEL与GroES以不对称地方式结合在一个环上,其余的则形成对称的复合物。在不对称复合物的自由环上检测到了底物蛋白的结合,从而确定底物的受体状态。
通过体外获得的高分辨率结构对GroEL-GroES室进行的原位分析表明,包裹的底物蛋白在释放到细胞质之前处于折叠状态。基于对伴侣蛋白复合物的全面量化和构象分析,研究人员提出了一个GroEL-GroES反应循环,该循环由关联的不对称和对称子反应组成,介导蛋白质折叠。该发现直接揭示了细胞内伴侣蛋白的原生构象和功能循环。
文章来源: Wagner, Jonathan, Carvajal, Alonso I. et al,Visualizing chaperonin function in situ by cryo-electron tomography.DOI: 10.1038/s41586-024-07843-w,Nature:,最新IF:69.504







