当我们用显微镜观察,可看到细胞内的各种蛋白质和分子通过荧光标记发出独特的光芒,犹如夜空中的繁星,间接免疫荧光技术不仅能够精确定位这些分子的分布,还能够观察它们在生命活动中的动态变化。借助这一技术,科学家们能够更加深入地了解细胞的工作机制,从而为疾病的诊断和治疗提供全新的思路和方法。
一、实验原理
间接免疫荧光是一种高度灵敏的免疫学检测技术,它利用特异性抗体来检测细胞或组织样本中的特定抗原。通过使用未标记的第一抗体特异性结合抗原,然后利用荧光标记的第二抗体识别并结合第一抗体,从而在荧光显微镜下检测和定位目标抗原。
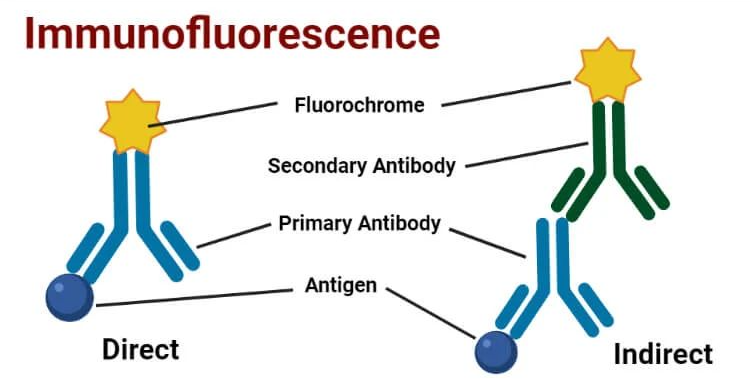
二、细胞系选择
体外培养的贴壁生长胃癌肿瘤细胞系:C*43-EGFP-BGC-823(稳转缝隙连接蛋白43)、EGFP-BGC-823(空载)。
三、实验步骤
1.对照组设置
确保阴性对照(无一抗或使用非特异性一抗)和阳性对照(已知表达目标抗原的细胞)的设置正确,以验证实验结果的特异性。
2.仪器兼容性检查
确认所使用的激光扫描共聚焦荧光显微镜的激光器激发波长与二抗标记的荧光染料的激发波长相匹配,以确保有效激发和检测。
3.细胞爬片制备
确保细胞培养条件适宜,如温度、CO2浓度。细胞密度达到70%-80%时,细胞处于对数生长期,适合进行实验。对于膜蛋白,建议细胞密度达到90%以上。
4.细胞状态检查
在镜检时,选择细胞状态良好、分布均匀的爬片,用适量PBS洗3次,每次2min。
5.固定
根据目标抗原的不同,选择合适的固定剂和固定时间。例如,GFP通常使用多聚甲醛固定。确保PBS洗涤充分,避免固定剂残留。本实验用冰甲醇(提前一天放-20℃预冷)固定2分钟或4%PFA 室温固定5分钟。
6.通透
使用0.5% Triton X-100/PBS进行细胞通透,时间控制在10-30分钟,以确保抗原的可访问性。PBS洗3次,每次5min。
7.封闭
使用5% BSA/PBS或与二抗相同宿主的血清进行封闭1h,以减少非特异性结合。
8.一抗孵育
确保一抗的稀释比例适当,以获得最佳染色效果。根据抗体特性选择孵育时间和温度。一般是室温或37℃约 1-2h 或4℃湿盒内过夜。
9.洗涤
使用0.01% Triton X-100/PBS洗涤3次,每次5-10min,以去除未结合的一抗。
10.二抗孵育
确保二抗的稀释比例适当,使用封闭液稀释。在孵育前,离心去除可能的聚集体。将荧光染料标记二抗按合适的稀释比稀释到封闭液中,配好后离心20min,转速 12000rpm,并加合适的量到盖玻片上,孵育约1h。
11.洗涤
再次使用0.01% Triton X-100/PBS洗涤,去除未结合的二抗。
12.染核
加适量DAPI(终浓度一般为0.5-1ug/mL)染核5 min。
13.洗涤
继续使用0.01% Triton X-100/PBS洗涤,去除DAPI残留。
14.去离子水洗涤
使用去离子水洗涤以去除盐结晶,避免影响显微镜下的观察。
15.封片
确保封片剂的配比正确,甘油:PBS=9:1。在封片时,注意避免气泡的产生,确保封片剂均匀覆盖。具体操作是将略晾干的细胞爬片的细胞面朝下贴在载玻片上,用镊子轻轻将气泡赶出,用卫生纸吸去周围多余的液体,用指甲油封边,晾干后(约20min)即可观测,也可放4℃避光保存。
四、结果解析
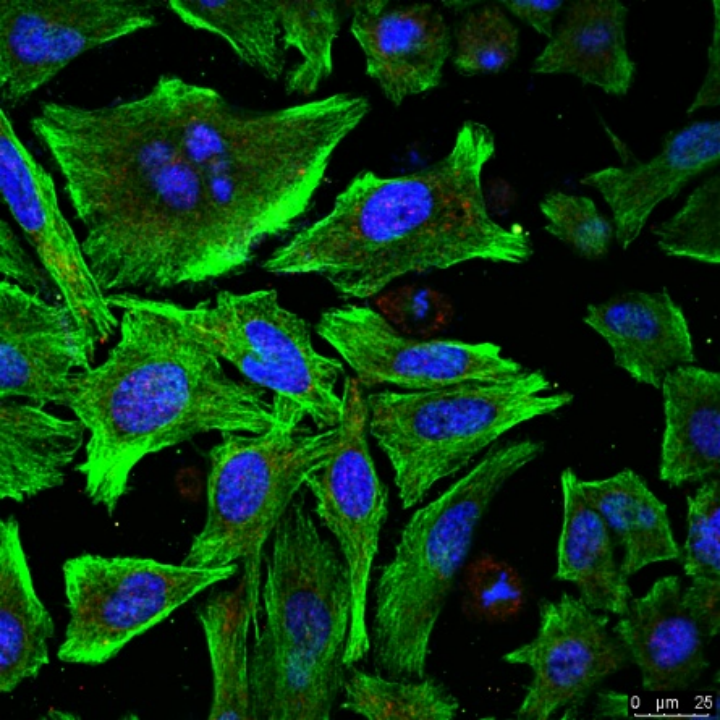
图片解析
1.胞核(蓝色):
蓝色染色通常使用DAPI(4',6-diamidino-2-phenylindole)或Hoechst染料。这些染料能够与DNA特异性结合,因此可以清晰地标记出细胞核。
图中可以看到每个细胞内的细胞核呈现为蓝色,细胞核形态清晰,可见多个核仁。
2.细胞骨架(绿色):
绿色染色可能是通过FITC(异硫氰酸荧光素)标记的抗体来染色的。绿色通常用来标记细胞骨架中的微管或肌动蛋白丝。
图中绿色部分展示了细胞骨架的结构,可以看到细胞的形状和内部结构。
3.其他结构(红色):
图中还可以看到一些红色的点状结构,这可能是其他荧光染料标记的细胞器或蛋白质,如线粒体或特定的细胞膜蛋白。