细胞消化方法通常可分为机械消化法、离子螯合法和酶消化法,这些方法用于将细胞结构破坏以获取细胞内的物质。在考虑细胞损伤和继续培养的情况下,胰酶消化法是最常用的方法。胰酶消化法能够有效地降解细胞表面的连接蛋白和基质质量,从而使细胞能够轻松地从培养基表面脱离。
然而,对于悬浮细胞的传代过程来说,相对而言机械消化法更为简单,无需使用酶类。因此,以贴壁细胞系为例,我们通常会选择酶消化法来进行细胞的处理。这种方法通过添加适量的胰酶等酶类来分解细胞表面的连接物质,使细胞能够以悬浮状态存在于培养基中。
细胞消化方法的选择取决于具体的实验目的和细胞类型。无论采用哪种方法,都需要细心操作以最大程度地保护细胞的完整性和生物活性,从而确保后续实验的准确性和可重复性。
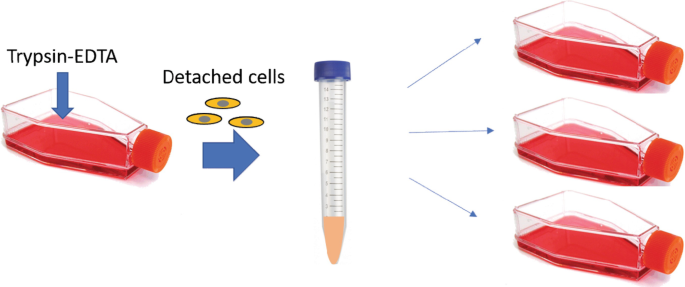
细胞消化:当细胞生长到密度接近80% 时,需要进行消化传代。
1.弃去旧培养基,用预热好不含钙离子、镁离子的PBS润洗两次,以去除旧培养基对胰蛋白酶消化的抑制作用。
2.加入适量的胰蛋白酶,放入培养箱中消化,根据不同细胞种类的不同消化时间,在显微镜下观察到细胞形态变圆脱落、细胞间隙变大、瓶底呈现花斑状时,用两倍于胰蛋白酶的完全培养基终止消化。
细胞分离:细胞消化后,九宫格法吹落细胞收集到离心管,以800-1000rpm,室温离心5min。弃去胰蛋白酶,用完全培养基充分重悬细胞。
细胞计数:使用血细胞计数器或自动细胞计数仪对细胞悬液进行计数,计算传代所需的细胞数量;或根据经验按照比例传代。
细胞传代:将培养瓶中加入部分完全培养基,而后取适量单细胞悬液加入混匀。
细胞培养:接种好细胞后,应在培养瓶上标记上细胞名称、传代日期和操作人姓名等信息,轻轻摇匀后转移到37℃、5% CO2培养箱中培养,并定期观测细胞状态。
注意事项:
1.细胞生长到覆盖70~80%瓶底时消化较好,若细胞密度过大则消化后细胞易成团。
2.在细胞消化时,应根据不同类型的细胞和不同实验目的选择适当的消化方法、消化液和消化时间。例如在使用流式细胞仪检测细胞凋亡等试验时,需要使用不含EDTA的弱消化液,以防止过度消化损伤细胞造成的细胞死亡影响实验结果。
- 比较难消化的细胞,可以分批次消化 ,减少过度吹打损伤细胞,避免先消化下来的细胞被过度消化。
- 比较容易消化的细胞可以选择浓度低的胰蛋白酶(一般采用的浓度为 0.1%-0.25%)或者用PBS稀释胰酶使用。
3.传代密度需要根据不同特点的细胞分别考虑,有些细胞有密度依赖,密度低导致的不增殖、细胞老化;同时也有密度高导致生长抑制或非单层生长导致不好消化的情况。
4.注意温度、PH、血清、钙、镁离子等因素对胰酶的抑制作用。