1、Cell Stem Cell:在胚胎早期阶段成功获得心脏类器官
2020年11月10日,来自瑞士洛桑联邦理工学院Matthias P. Lutolf及其研究组在《细胞—干细胞》发表了题为“ Capturing Cardiogenesis in Gastruloids.“的研究成果,发现在类原肠胚中实现心脏的发生。
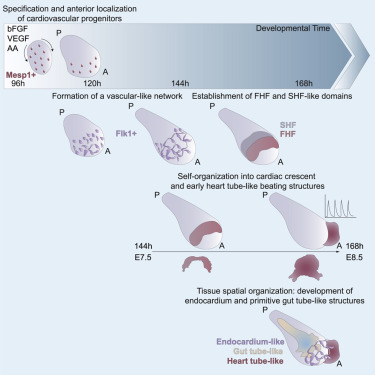
Fig 1|来源:Cell Stem Cell
研究人员发现,小鼠胚胎干细胞(mESC)可以被诱导,进而以体内类似的时空保真度稳健地经历早期心脏器官发生的基本步骤。这些轴向分化的胚胎类器官(类原肠胚)模拟了胚胎发育并支持心血管祖细胞的生成,包括第一和第二心脏区域。在原肠样管附近形成跳动的心脏组织之前,心脏祖细胞自组织成一个新月形的前部区域,从而心脏组织被心内膜样层隔开。
这些发现揭示了mESC通过多种组织的协调发育来执行器官发生的惊人潜力。这个平台可能是研究心脏发育的绝佳工具,它具有前所未有的细节和通量。
据介绍,类器官是研究组织发育、生理和疾病的强大模型。然而,当前的培养系统破坏了天然器官发生的复杂形态发生过程所需的诱导性组织-组织相互作用。
(评论:科幻中的画面即将变成现实了。)
文章来源:
Giuliana Rossi, Nicolas Broguiere et al, Capturing Cardiogenesis in Gastruloids. DOI: 10.1016/j.stem.2020.10.013. 最新IF:21.464
2、Cell Reports:痛经和不孕的子宫内膜异位症有望被治疗
2020年11月10日,来自密歇根州立大学 Ronald Chandler 团队在Cell Reports上发表了题为: ARID1A Mutations Promote P300-Dependent Endometrial Invasion through Super-Enhancer Hyperacetylation的研究论文。该研究确定了治疗严重子宫内膜异位症的潜在遗传靶标,有望为患有严重子宫内膜异位症的女性开发更好的治疗方法。
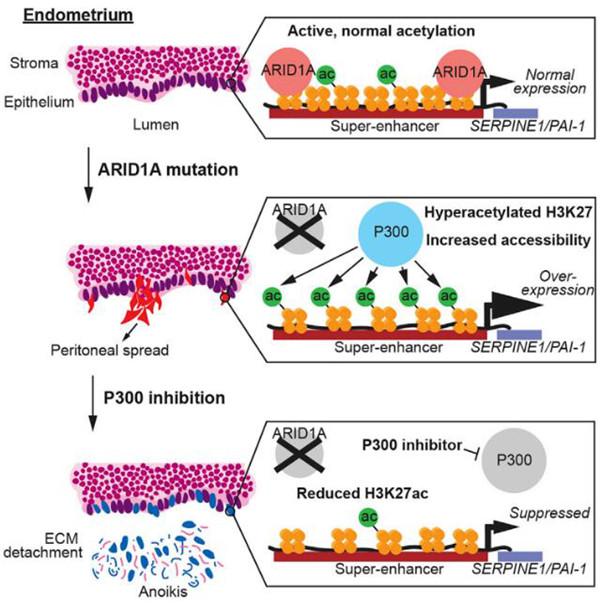
Fig2 | 来源:cell reports
研究团队聚焦于一类特殊的子宫内膜异位症患者, 子宫内膜异位症,特别是与ARID1A突变相关的子宫内膜异位症,与更具侵袭性和疼痛性的疾病有关,常常导致不孕。当ARID1A发生突变时,所谓的“超级增强子”就会失控。这使得正常排列在子宫周围的细胞在子宫外形成深部植入物,引起严重的盆腔疼痛。
ARID1A与P300共定位于超级增强子,在ARID1A突变型子宫内膜上皮细胞中,对P300的遗传或药理抑制作用,可抑制子宫内膜上皮细胞的侵袭,并通过挽救超级增强子的乙酰化诱导上皮细胞的凋亡。
基于上述研究发现,研究团队测试了靶向P300的抑制剂,该抑制剂能够抑制P300,从而抑制超级增强子,并抵消ARID1A基因突变的影响。该抑制剂是一种控制基因表达方式的新型治疗方法,称为“表观遗传疗法”。
(评论:这种方法可能比手术治疗、激素治疗及止疼药有效得多)
文章来源:
Mike R. Wilson,Jake J. Reske et al. ARID1A Mutations Promote P300-Dependent Endometrial Invasion through Super-Enhancer Hyperacetylation. DOI:https://doi.org/10.1016/j.celrep.2020.10836
3、Nature Neuroscience:Tau在星形胶质细胞中积累诱发AD
2020年11月9日,来自瑞士洛桑大学医院(CHUV)和洛桑大学精神病学神经科学中心Nicolas Toni、Kevin Richetin研究组合作在《自然-神经科学》发表了题为“Tau accumulation in astrocytes of the dentate gyrus induces neuronal dysfunction and memory deficits in Alzheimer’s disease .“的最新进展研究论文。提出Tau在齿状回星形胶质细胞中的积累会诱发阿尔茨海默氏病(AD)的神经元功能障碍和记忆力减退。
他们发现tau在AD个体齿状回的肺门星形胶质细胞中积累。在小鼠中,在齿状回的肺门星形胶质细胞中3R tau的过度表达改变了线粒体的动力学和功能。反过来,这些变化导致成人神经发生,表达小白蛋白的神经元、抑制性突触和肺门伽马振荡的减少,并伴有空间记忆性能的下降。
总之,这些结果表明,齿状回的肺门星形胶质细胞中tau稳态的丧失足以通过神经元网络的损伤而诱发AD样症状。
(评论:对人们理解疾病机制很重要,也强调了星形胶质细胞在海马功能中的关键作用。)
文章来源:
Kevin Richetin, Pascal Steullet et al, Tau accumulation in astrocytes of the dentate gyrus induces neuronal dysfunction and memory deficits in Alzheimer’s disease. DOI: 10.1038/s41593-020-00728-x Nature Neuroscience:最新IF:21.126