在前面的《盘点癌细胞逃避人体免疫系统攻击的各种伎俩》一文中我们给大家介绍了癌细胞逃避人体免疫系统攻击的一些小花招。相信已经让大家大开眼界了,不过今天我们要揭露一些更加重磅的手段,惊悚至极,堪称细胞层面的黑暗魔法!
一、远程召唤神经干细胞
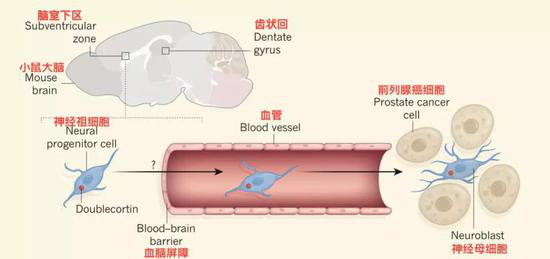
2017年的一天,法国科学家Claire Magnon和她的学生被一组数据吓坏了。她们发现:移植到模式小鼠身上的前列腺肿瘤生长一段时间之后,小鼠大脑脑室下区的神经干细胞(或者神经祖细胞)数量突然减少了。仔细想想有2个可能:最容易想到的就是它们都挂了,没毛病;还有另外一个就比较惊悚了,那就是这些神经干细胞跑到其他地方去了,那到底是死了,还是走了呢?几个月前,Magnon经过多番严谨的验证之后,终于将她的研究成果发表在《自然》杂志上。结果是:那些消失的神经干细胞走了,而且是顺着血管迁移到前列腺肿瘤里面去了…… 是不是有鬼片的感觉?
在以前的临床研究中就发现癌症患者存在认知能力下降的现象,虽然有人指出,这可能与患者接受治疗有关。但是Magnon的研究为另一种观点提供了证据,癌症患者在接受治疗之前就出现了认知障碍,因为大脑的神经干细胞被肿瘤“召唤”走了。
神经干细胞进入肿瘤流程图
肿瘤的形成和发展,离不开血管、淋巴管和神经,切断神经纤维,或者用药物阻断神经信号的传递,可以有效抑制肿瘤的生长,减少癌细胞的扩散转移。神经网络对肿瘤生长和发展的重要性可见一斑。
Magnon教授团队构建了模式小鼠。然后将前列腺肿瘤移植到小鼠身上,一段时间后,她们观察到了刚才提到的现象:脑室下区的神经干细胞减少了。不过这显然不足以证明肿瘤内的神经干细胞就是脑室下区消失的那些。为了解决这个问题她们给小鼠大脑中的神经干细胞做了荧光标记。最终结果发现有荧光标记的神经干细胞如约出现在距离大脑很远的肿瘤中。肿瘤中的神经干细胞的的确确来自大脑!
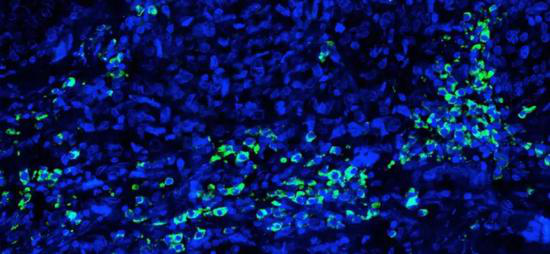
后续分析发现,移植了肿瘤的小鼠脑室下区的血脑屏障通透性异常,变得有利于神经干细胞通过,并进入血液(好像被放行了)。是不是被吓坏了?相比之下,我们以前说的分泌外泌体、“囚禁”T细胞简直弱爆了。还有几种没这么惊悚,不过也挺魔性的:
二、夺取“健康指纹”,伪装成超级健康的细胞
最近,葡萄牙Champalimaud未知中心的研究人员发现癌细胞可挟裹组织中细胞间的竞争机制,夺取“健康指纹”,为自己穿上“健康”外衣,从而破坏健康细胞组织,为肿瘤扩张开路!
研究人员发现机体正常组织中存在细胞间的竞争机制。正常细胞表面可根据细胞健康状态表达花膜蛋白,其中hFWE1和hFWE3表达Flower-Lose蛋白,hFWE2和hFWE4表达Flower-Win蛋白,这两种蛋白的不同含量体现了细胞的健康状况。“Win”蛋白越多,细胞越健康,“Lose”蛋白则预示着细胞的受损和衰老情况,这就是细胞的“健康指纹”。正常细胞表面“Win”蛋白表达较少,多以“Lose”蛋白的累积来体现细胞健康状态。他们指出,正常组织中,根据不同的“指纹”,健康的细胞就可以吞噬破坏衰老受损的细胞,这就是正常细胞的自净平衡。
当细胞发生癌变时,其表面会大量表达“Win”蛋白,“Lose”蛋白表达减少甚至不表达,从而将自身伪装成超级健康的细胞,相对应的,癌细胞周围“Lose”蛋白表达增加的健康细胞就变得“不那么健康”。根据细胞自净机制,癌细胞不仅可以欺骗周围细胞防止被吞噬,还可以正大光明理直气壮地根据“健康指纹”对周围细胞大肆破坏,使其于众细胞中脱颖而。而且,肿瘤恶性程度越高,这种细胞间的“健康对比”就愈发强烈!这种对比可预测86.3%的恶性肿瘤!也就是说,“健康指纹”就是一把双刃剑,既可以守护健康,亦是癌症发生发展侵袭的助力!
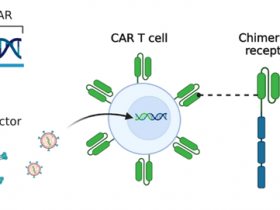
三、迷惑CAR-T细胞自相残杀
纪念斯隆凯特琳癌症中心的Mohamad Hamieh和Michel Sadelain等研究发现,面对来势汹汹的CAR-T治疗,癌细胞竟然能把自身的抗原转移到CAR-T细胞上,在逃避免疫治疗的同时让CAR-T细胞自相残杀。相关研究发表在Nature上。
在前面的《免疫治疗那点事儿》中我们提到过CAR-T治疗,通过在患者自身的T细胞上引入肿瘤特异性嵌合抗原受体,让T细胞能更好地识别杀伤肿瘤,在很多血液系统肿瘤中取得了很好的效果。不过CAR-T效果虽好,肿瘤复发的问题却也屡见不鲜。而这些复发的癌细胞上,原本被CAR-T靶向的抗原,要么完全消失,要么大幅减少,让肿瘤对CAR-T治疗产生了耐药性。
其中,完全丢失主要是由肿瘤的各种基因突变造成的,但那些抗原靶点大幅下调,却没有完全消失的癌细胞,是怎么让抗原靶点下调的却一直不清楚。对此,研究人员展开了研究。
研究人员对急性淋巴细胞白血病(ALL)模型小鼠,给予了有限的,分别携带CD28(19-28ζ)或者4-1BB(19-BBζ)共刺激因子的CAR-T治疗,模拟了CAR-T治疗后的复发。2周后,输入的CAR-T消耗殆尽后,研究人员发现接受19-BBζ治疗的小鼠中的癌细胞上,CD19的表达量,从原来的平均每个细胞表达11000个CD19,下降到了4500个/细胞。但接受19-28ζ治疗的小鼠中,癌细胞CD19表达量没有变化。为了搞清这些少了的CD19去哪了,研究人员在体外把癌细胞和19-BBζ共培养。仅仅1小时后,癌细胞上的CD19就大幅下降了,不过癌细胞中CD19的mRNA水平却没有明显的变化,而在共培养的19-BBζ CAR-T细胞上却出现了大量的CD19。研究人员给癌细胞的CD19分子接上了个荧光标签,共培养后,19-BBζ细胞表面果然出现了带荧光标签的CD19。还真是癌细胞把自己的表面抗原转移给了CAR-T细胞!
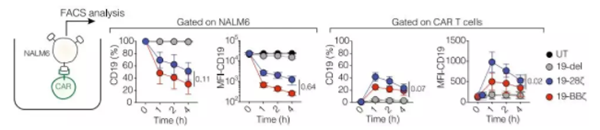
共培养下,癌细胞上CD19减少,而CAR-T上出现CD19
进一步研究发现,只有那些具有胞啃(trogocytosis)能力的19-BBζ细胞,才会接受癌细胞上的靶抗原。胞啃是指淋巴细胞通过免疫突触,从抗原提呈细胞上啃下了一部分表面分子。胞啃的功能目前还不是很清楚,可能对免疫反应的诱导和调节,以及其他细胞系统的控制有重要作用。不过在这里,胞啃成为了癌细胞对抗免疫治疗的利器。除了减少癌细胞上的抗原数量,让癌细胞耐药外,胞啃还让CAR-T细胞带上了它所要攻击的靶点,使它们互相残杀。
此外,治疗B细胞白血病的其它CAR-T靶点,如CD22、成熟B细胞抗原(BCMA)和间皮素(mesothelin)等,在相应的CAR-T治疗中,也出现了被靶向的癌细胞抗原转移到相应CAR-T细胞上的现象。这一免疫治疗耐药机制或许普遍存在!
四、利用中性粒细胞来增强癌症转移的能力
肿瘤细胞会利用中性粒细胞来增强癌症转移的能力,近期,来自巴塞尔大学等机构的科学家们通过研究阐明了肿瘤细胞发生上述行为的机制,同时还发现了阻断癌细胞发生转移的特殊策略,相关研究结果刊登于国际杂志Nature上。这项研究中,研究人员不仅清楚阐明了循环肿瘤细胞-中性粒细胞细胞簇在癌症转移过程中扮演的关键角色,还发现,中性粒细胞能通过释放特殊的信使物质(比如细胞因子)来增强循环肿瘤细胞的转移能力,当细胞因子的释放过程被阻断后,中性粒细胞的这种促癌症转移效应也会被抑制。
五、改变肺中的细菌群落帮助细胞茁壮成长
包括300多万个基因的1000多种细菌构成了人体内的微生态,直接影响着人类健康和疾病,被称之为人的第二基因组。而细菌与癌症,也从来都是相爱相杀的关系。在近期的《Cell》杂志上,来自麻省理工的科学家们又找到了他们彼此“感情”的新证据:肿瘤细胞可通过改变肺中的细菌群落,刺激免疫系统创造一种炎症环境,进而帮助肿瘤细胞茁壮成长。