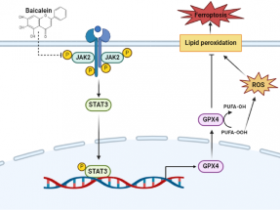
2024年11月25日,来自西湖大学邹贻龙等研究人员合作在《细胞》杂志发表了标题为“ACSL4 and polyunsaturated lipids support metastatic extravasation and colonization.”的研究成果,发现ACSL4和多不饱和脂质支持转移性外渗和定植。
据悉,癌细胞向远处器官的转移扩散,要求癌细胞具有高度的形态和代谢适应性。癌细胞的各种内在特征和外在因素是实现外渗的必要条件,包括细胞运动性增强、癌细胞膜内脂质相行为改变,以及趋化因子、趋化因子受体和细胞-细胞黏附分子的改变。然而,我们对支持癌细胞转移性外渗的脂质组的特征仍然知之甚少。
研究人员揭示了转移潜力与铁死亡易感性之间的关联。在卵巢癌患者的转移性癌细胞中,铁死亡敏感性和多不饱和脂肪酰(PUFA)脂质含量较来自原发肿瘤的细胞更高。
研究的核心发现 :
1、泛癌表型数据挖掘揭示转移-铁死亡敏感性之间的相关性;
2、聚焦代谢的体内CRISPR筛选揭示了ACSL4的促转移作用;
3、ACSL4通过增强膜流动性和侵袭性促进转移性外渗;
4、高不饱和脂肪酸脂质 的 肿瘤细胞依赖于ECH1等限速酶进行β-氧化和转移;
5、共抑制ACSL4和ECH1,可有效抑制肿瘤转移。
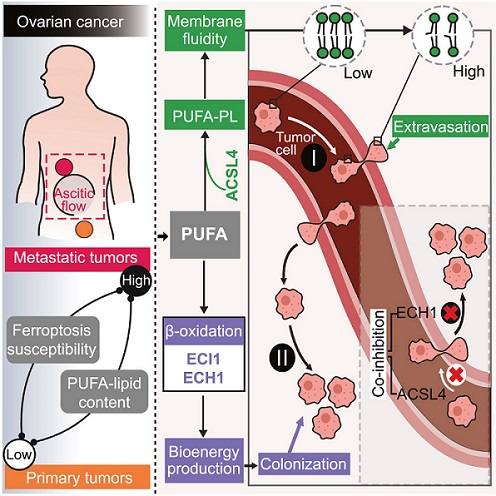
通过两轮体内选择建立的,卵巢癌远程转移小鼠模型中的代谢聚焦CRISPR筛选发现,多不饱和脂肪酸脂质合成酶——长链酰基辅酶A合成酶家族成员4(ACSL4)是促血源性转移的因素。ACSL4通过增强膜流动性和细胞侵袭性促进转移性外渗。
在促进转移的同时,高PUFA脂质状态依赖于含有水解酶结构域6酰甘油脂肪酶(ABHD6)、烯酰辅酶A δ异构酶1(ECI1)和烯酰辅酶A水合酶1(ECH1)——这些限速酶为不饱和脂肪酸(UFA)的β-氧化做准备。ACSL4/ECH1的共同抑制显著抑制了转移。
该研究揭示了PUFA脂质在肿瘤进展和转移中的双重功能,这一机制可能为治疗开发提供可利用的靶点。卵巢癌进展依赖于不饱和脂肪酸至少两种看似独立的功能,包括其氧化以产生能量,以及并入磷脂以增强膜流动性、迁移潜能和外渗效率。这项研究为发生在卵巢和其他部位的转移性癌症提出了一种潜在的联合治疗策略。
文章来源:
Yuqi Wang, Mangze Hu, Jian Cao et al,ACSL4 and polyunsaturated lipids support metastatic extravasation and colonization.DOI: 10.1016/j.cell.2024.10.047,Cell:最新IF:66.85