2024年10月16日,来自美国德克萨斯大学Xi Chen研究小组在学术期刊《细胞》上发表了标题为“IRE1α silences dsRNA to prevent taxane-induced pyroptosis in triple-negative breast cancer.”的研究成果,发现IRE1α通过沉默dsRNA来防止三阴性乳腺癌中紫杉类药物诱导的细胞焦亡。
据介绍,化疗通常与ICI联合使用,以增强免疫治疗的反应。尽管化疗联合免疫疗法已获批准用于多种人类癌症,许多免疫冷肿瘤仍对治疗无反应。化疗免疫原性的决定机制尚不清楚。
免疫检查点阻断(immune checkpoint therapy)疗法是一类通过阻断抑制T细胞活性的信号通路来提高抗肿瘤免疫反应的治疗方法。其中最典型的靶点是CTLA-4和PD-1/PD-L1。该疗法对不同类型的癌症显示出明显疗效,彻底改变了肿瘤治疗的策略。据肿瘤中淋巴细胞的浸润程度,可将其分为“热肿瘤” 和“冷肿瘤”。热肿瘤中淋巴细胞浸润丰富因而对免疫疗法反应良好。冷肿瘤中缺乏免疫细胞浸润因而对免疫疗法具有抵抗性,是肿瘤免疫治疗面临的一大挑战。
研究人员确定了内质网应激传感器IRE1α是限制紫杉类化疗免疫刺激效应的关键检查点,并防止免疫冷的三阴性乳腺癌(TNBC)被先天免疫识别。IRE1α核酸酶通过受调节的IRE1依赖性降解(RIDD)沉默紫杉类药物诱导的双链RNA(dsRNA),从而防止NLRP3炎性小体依赖的细胞焦亡。
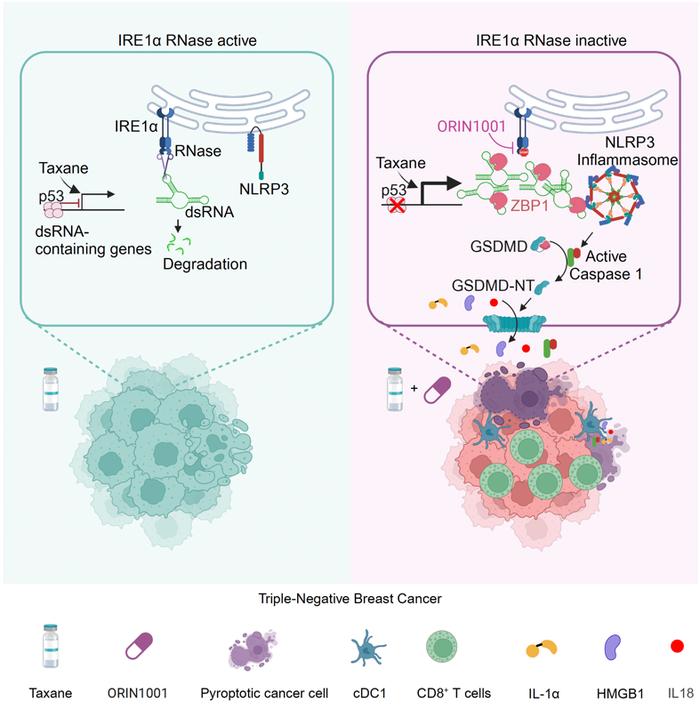
RE1α抑制化疗药引起的热死亡和免疫刺激
抑制Trp53−/− TNBC中的IRE1α允许紫杉类药物诱导大量dsRNA,这些dsRNA被ZBP1识别,进而激活NLRP3-GSDMD介导的细胞焦亡。
因此,IRE1α核酸酶抑制剂加紫杉类药物可将PD-L1阴性、对免疫检查点抑制剂(ICI)无反应的TNBC肿瘤转化为PD-L1高表达的免疫原性肿瘤,进而对ICI高度敏感。研究人员揭示了IRE1α作为癌细胞防御机制,防止紫杉类药物引发的危险信号积累和细胞焦亡。
文章来源:
Longyong Xu, Fanglue Peng, Qin Luo, Yao Ding et al, IRE1α silences dsRNA to prevent taxane-induced pyroptosis in triple-negative breast cancer.DOI: 10.1016/j.cell.2024.09.032,Cell:最新IF:66.85







