在前面的《表观遗传学的神奇世界》和《表观遗传学新发现-童年生活的经历会通过精子遗传给后代》
等文章中我们给大家介绍过 表观遗传学(epigenetics)是指不涉及DNA 序列改变的基因或者蛋白表达的变化, 并可以在发育和细胞增殖过程中稳定传递的遗传学分支学科。表观遗传的现象很多,已知的有DNA甲基化(DNA methylation),基因组印记(genomic impriting),母体效应(maternal effects),基因沉默(gene silencing),核仁显性,休眠转座子激活和RNA编辑(RNA editing)等,国际上表观遗传学已经构成了系统遗传学研究的一个重要方面。表观遗传学这门学科已经在肿瘤生成和治疗、干细胞分化等诸多领域扮演了重要角色。今天我们再来分享一些该领域最新进展:
一.与照顾者的社会互动或影响婴儿的性格
催产素是一种极其重要的激素,它参与了包括人类在内哺乳动物的社会互动和社会关系。它可以帮助我们与他人建立联系,增强彼此之间的信任与亲密关系,而且该激素可以通过目光接触、共情作用或愉悦触摸来触发。众所周知,新妈妈的行为受催产素水平的影响,因此,母亲与婴儿之间的关联也受催产素影响。
近日发表在《Science Advances》上的一项表观遗传学研究表明,母亲的行为也可能对其子女催产素系统的发育产生重大影响。该研究由美国弗吉尼亚大学与马克斯·普朗克人类认知与大脑科学研究所(MPI CBS)共同完成。
童年是出生后动态且可塑的生长发育阶段。许多身体系统开始运转、成熟或得到调整,并伴随着我们的心理和行为轨迹逐渐进入成年期。大自然发挥着明显作用,通过基因塑造人类。但是,人与人之间以及人与环境之间的相互作用也显著地影响着人类。该研究联合通讯作者、马克斯·普朗克人类认知与大脑科学研究所的Tobias Grossmann说:“众所周知,内源性催产素在早期的社交、感知和认知过程中发挥着积极的作用,并且会影响复杂的社交行为。但是,在这项研究中,我们想确定母亲的行为是否会对婴儿催产素系统的发育产生决定性影响。
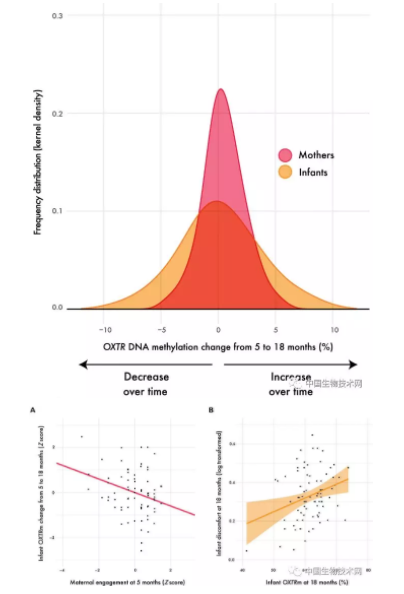
近年来,分子生物学,尤其是表观遗传学的进展,使研究先天与后天或遗传与环境因素的相互作用成为可能,在这项研究中,环境因素指的是对婴儿的精心护理。这正是我们在这项研究中所做的。”在研究中,研究人员观察了母亲与五月龄婴儿之间的自由互动。该研究通讯作者、弗吉尼亚大学心理学系Jessica Connelly教授实验室的博士后研究员Kathleen Krol说:“我们在探视期间从母亲和婴儿那里收集了唾液样本,然后在一年后,即孩子18个月大时收集了唾液样本。我们感兴趣的是在最初的互动中,母亲的参与是否会在一年后对孩子催产素受体基因产生影响。催产素受体对于催产素发挥至关重要的作用,它可以决定产生多少催产素。”在该研究中,研究人员对母亲与5月龄婴儿之间的自由互动进行了观察。
研究人员解释说:“我们发现婴儿的DNA发生了表观遗传变化,并且这种变化可以由母亲参与游戏过程的质量来预测。如果母亲参与游戏时很投入,则一年之后催产素受体基因的DNA甲基化程度就会大大减少。此前有研究显示该区域的DNA甲基化减少与催产素受体基因的表达增加有关。因此,母亲更多地参与似乎可以增强后代的催产素系统。重要的是,我们还发现DNA甲基化水平反映了婴儿的性格,这是父母们向我们报告的。在18个月时甲基化水平较高且催产素受体水平较低的孩子,更加容易喜怒无常。”
图片来源:《Science Advances》
这项研究的结果提出了一个惊人的观点,即人类不仅受基因的控制,遗传因素与经历之间微妙的相互作用也在塑造着人类。早期与照顾者的社会互动,当然不排除父亲,可以通过催产素系统的表观遗传变化影响生物学和心理发育。这些相关发现表明了育儿工作在促进跨代健康方面的重要性。
二.表观遗传药物
今天,我们来介绍一组全新的抗癌药:表观遗传学药物,这是一类新型的抗癌药,是近几年来学术界和药厂关注的“新宠”。初步临床数据显示:表观遗传学药物可能是PD-1抗体的“黄金搭档”,可以增敏甚至逆转PD-1抗体耐药。
在前面的《癌症的表观遗传学研究进展》一文中我们已经知道了癌细胞和表观遗传学的关系,那么对应的表观遗传学药物也就应运而生,其中最有代表性的药物就是:甲基转移酶抑制剂、组蛋白去乙酰化酶抑制剂。
近年来,越来越多的证据显示:这两类表观遗传药物,可以大幅度提高PD-1抗体的敏感性甚至克服PD-1的耐药,从而显著提高抗癌的疗效。
- 甲基转移酶抑制剂与PD-1抗体
2019年4月30日,肿瘤学领域顶尖杂志《JCO》发表了解放军总医院生物治疗科韩为东教授领衔的一项2期临床试验结果,发现甲基转移酶抑制剂(地西他滨)可以增敏PD-1疗效,逆转耐药。
这项研究入组了86名复发难治性(入组患者至少已经接受过2套其他标准治疗,结果依然复发、进展)的经典型霍奇金淋巴瘤(cHL)患者,一共分成3个小组,患者情况和疗效具体如下:
第一组:19名未接受过PD-1治疗的病友,接受恒瑞PD-1单药治疗,有效率90%,完全缓解率32%;
第二组:42名未接受过PD-1治疗的病友,接受恒瑞的PD-1联合甲基转移酶抑制剂(地西他滨)治疗,有效率为95%,完全缓解率71%;
第三组:25名接受过PD-1治疗,但是治疗无效或者耐药的病友,接受恒瑞PD-1联合甲基转移酶抑制剂(地西他滨)治疗,有效率为52%,完全缓解率为28%。
所以:第二组和第一组对比,可以发现,地西他滨的加入,让完全缓解率翻了一倍多(从32%到71%);第三组数据显示,PD-1单药无效或者耐药的cHL病人,联合上地西他滨后超过一半(52%)的患者客观有效。
地西他滨的加入,不仅提高了完全缓解率,似乎也能提高疗效的维持时间。整组患者随访半年以上,发现第一小组6个月的疗效保持率为76%,第二小组是100%。此外,患者的生存期也明显延长。
这一串数据,说明地西他滨可能拥有增敏PD-1并克服耐药的强悍实力,当然,后续还需要更大规模的研究来进行确认。PD-1联合地西他滨这样的方案,不仅仅在淋巴瘤中有好处,在其他实体瘤中也有小规模的不俗的数据。
- 组蛋白去乙酰化酶抑制剂与PD-1抗体
除了甲基转移酶抑制剂外,在体外细胞实验以及动物模型中,组蛋白去乙酰化酶抑制剂已经多次被证明可以增敏PD-1抗体。
2019年4月16日,来自德国海德堡大学(这是全欧洲享有盛誉的肿瘤免疫学研究重镇)的Becker JC教授报道了相关的临床实例。4名晚期默克尔细胞癌患者接受单药PD-1抗体治疗无效,深入的免疫学分析提示:患者肿瘤组织中抗原呈递相关的蛋白表达过低,导致肿瘤相关的抗原不能被处理、呈递,从而导致T细胞不能识别肿瘤,最终导致免疫治疗无效。
紧接着,两名患者接受了PD-1抗体联合组蛋白去乙酰化酶抑制剂panobinostat(帕比司他)治疗,其中一位患者治疗后活检提示:抗原呈递相关蛋白的表达明显提高,肿瘤组织中浸润的T细胞明显增多。
据了解,在国内也有一个PD-1抗体联合表观遗传学药物的临床试验,使用的是信达的PD-1单抗+信达IBI305(国产贝伐)+微芯生物的西达本胺,三药联合用于晚期肠癌。该临床试验正在紧锣密鼓的筹备中,预计将在国内招募志愿者,探索和论证PD-1抗体联合组蛋白去乙酰化酶抑制剂的安全性和疗效。








