2024年11月29日,来自法国分子细胞与遗传学研究所Albert Weixlbaumer和Michael W. Webster共同合作在《科学》杂志上发表了标题为“Molecular basis of mRNA delivery to the bacterial ribosome.”的研究成果,研究发现了mRNA传递到细菌核糖体的分子基础。
储存在 DNA 中的遗传信息通过 RNA 聚合酶 (RNAP) 转录成信使 RNA (mRNA),并通过核糖体翻译成蛋白质。在原核生物中,基因的转录和翻译同时发生且邻近发生。这使得 RNAP 和核糖体能够协调它们的功能。转录和翻译机制之间的这种耦合的一个鲜为人知的方面是 RNAP 可能促进核糖体与它正在转录的 mRNA 的结合。mRNA“递送”到核糖体的机制将保护中间的 mRNA 免受核糖核酸酶的侵害,抑制抑制性 RNA 结构的形成,并通过将其与尾随核糖体的翻译活性偶联来加速转录。
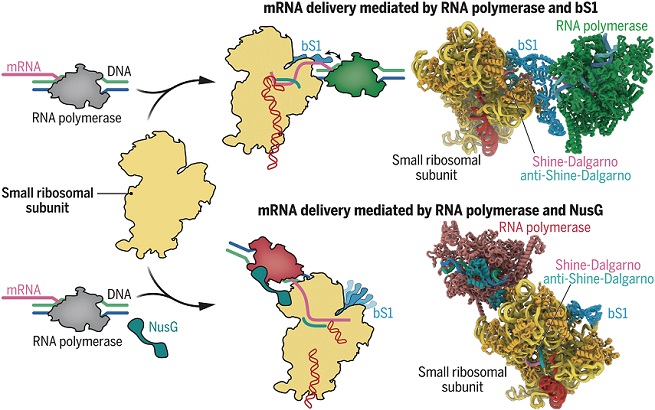
mRNA 和核糖体之间的初始接触通常由核糖体蛋白 bS1 支持,核糖体蛋白 bS1 是大肠杆菌中大多数 mRNA 翻译所需的 RNA 结合蛋白。在核糖体表面,bS1 位于核糖体 RNA 序列附近,该序列可以与 mRNA 中的 Shine-Dalgarno (SD) 基序碱基配对。因此,核糖体和 mRNA 之间稳定复合物的建立可能取决于 bS1、SD 基序和 RNAP 之间的协调。
核糖体募集到 mRNA 的早期步骤。
在细菌翻译起始途径中,已经表征了核糖体中 mRNA 调节和起始转移 RNA (tRNA) 结合的分子基础。相比之下,关于翻译起始早期阶段(mRNA 和核糖体首次相互作用)的结构信息是有限的。RNAP 如何促进翻译的启动也尚不清楚。研究人员试图使用结构、生物物理和蛋白质组学方法的组合来可视化 mRNA 最初是如何被细菌核糖体参与的。
为了通过冷冻电子显微镜 (cryo-EM) 进行结构分析,研究人员制备了一个复合物,其中小核糖体亚基与 RNAP 中出现的 mRNA 结合。确定了一组分子状态的结构,这些分子状态揭示了 mRNA 从 RNAP 递送到核糖体的两条途径。在第一种研究中,从 RNAP 中出来的 mRNA 与核糖体蛋白 bS1 结合。这阐明了 bS1 如何支持与 mRNA 的初始接触并促进它们在核糖体内折叠以适应。mRNA 的 SD 基序与核糖体 RNA 以先前未描述的方向碱基配对。mRNA 从 bS1 到 SD 基序识别位点的连续路径揭示了 bS1 如何在 mRNA 调节和 tRNA 识别之前递送 mRNA 以促进稳定的核糖体-mRNA 复合物形成。
RNAP 位于这些结构中 bS1 附近。这表明 bS1 有助于 RNAP 介导的 mRNA 递送到开创性的核糖体,研究人员通过体外单分子共定位实验证实了这一点。仅在 bS1 存在下观察到核糖体与 RNAP 内 mRNA 的关联速率增加。
在其他结构模型中,RNAP 通过偶联因子 NusG 与小核糖体亚基相连。在这里,mRNA 被递送到核糖体的 mRNA 进入通道,而不是 bS1。这表明 NusG 及其旁系同源物 RfaH 可能支持 mRNA 递送至核糖体的替代途径。最后,研究人员证实,使用细胞内化学交联结合质谱法,在研究人员的重构样品中观察到的核糖体和 RNAP 之间的两个接触位点都发生在活细胞中。
结构模型提供了对 RNAP、bS1 和 SD 基序在翻译起始早期阶段的作用的机制见解。在核糖体结合和细胞内结构蛋白质组学数据的动力学分析的支持下,研究人员提出了一个 mRNA 递送到细菌核糖体的两种途径的模型。
总之,这一工作为SD双链体、核糖体蛋白和RNAP如何在mRNA的30S募集中合作,并建立转录-翻译偶联提供了一个机制框架。
文章来源:
Michael W. Webster, Adrien Chauvier, Huma Rahil et al, Molecular basis of mRNA delivery to the bacterial ribosome.DOI: DOI: 10.1126/science.ado8476,Science:最新IF:63.714







