
程序性细胞死亡研究层出不穷,本期小编要与大家分享的是细胞状态研究的另一热点专题——铁死亡(Ferroptosis),从过去几年国家自然科学基金中标的项目我们发现,从2013年申请第一项关于“铁死亡”的项目,2017年增加到16项,到2019年增至76项,累计资助经费6008.2万,都说明了铁死亡研究不断受到科学家的重视,成为细胞死亡研究新的“宠儿”。
说到铁死亡,小伙伴们就会有很多疑惑了:铁死亡是不是与铁离子有关系呢?它的原理是什么呢?它与细胞凋亡、坏死的区别是什么呢?我们应该从哪些方面来研究它呢?
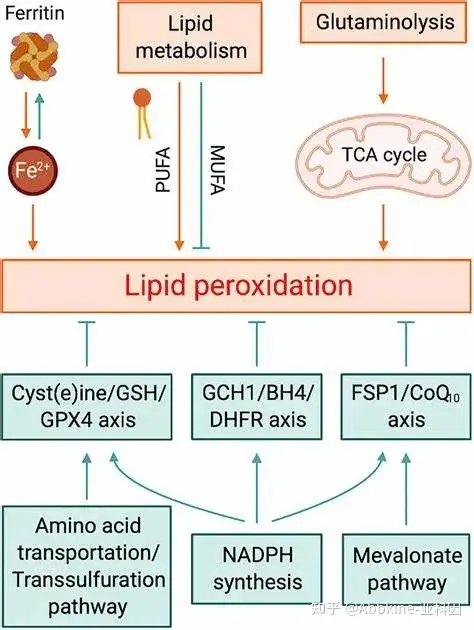
从发生机制上讲铁死亡主要是在二价铁离子或酯氧合酶的作用下,催化细胞膜上高表达的不饱和脂肪酸,发生脂质体过氧化,从而诱导细胞死亡,还表现在抗氧化体系谷胱甘肽GSH和谷胱甘肽过氧化物酶4-GPX4的表达量降低。
铁死亡主要有以下几个特点:
一、细胞形态方面:铁死亡会导致细胞线粒体变小,膜密度增高,嵴减少、消失,外膜破碎。细胞核中形态变化不明显。
超微形态学特征显示细胞膜断裂和出泡,线粒体变小、膜密度增高、线粒体脊减少或消失、线粒体外膜断裂,细胞核大小正常、但缺乏染色质凝聚。电镜下表现为细胞内线粒体变小及双层膜密度增高。
二、细胞成分方面:铁死亡表现为脂质过氧化增高,ROS升高。也有一些特征基因发生变化。
(1)生物学特征为铁和活性氧(ROS)聚集,激活丝裂原活化蛋白激酶(mitogen-activatedprotein kinase,MAPK)系统,通过降低胱氨酸的摄取、耗竭谷胱甘肽,抑制ystem Xc-和增加还原型酰腺嘌呤二核苷酸磷酸氧化酶,释放花生四烯酸等介质。
(2)免疫学特征为损伤相关分子模式(damage-associatedmolecular patterns molecules,DAMPs)释放前炎症介质(如高迁移率族蛋白B1等)。
(3)基因水平上主要受核糖体蛋白L8(ribosomalprotein L8,RPL8),铁反应元件结合蛋白(ironresponse element binding protein 2,IREB2),ATP合成酶F0复合体亚基C3(ATP synthase F0 complex subunit C3,ATP5G3),三四肽重复结构域35(tetratricopeptide repeat domain 35,TTC35),柠檬酸合成酶(citratesynthase,CS),酰基辅酶A合成酶家族成员2(acyl-CoA synthetase family member 2,ACSF2)以及受代谢、储存基因TFRC、ISCU、FTH1、FTL、SLC11A2的调节。
现在比较认可的铁死亡的检测方法如下所示:
1、新陈代谢
(1) 细胞活性:CCK-8;
(2) 细胞内铁水平:可以使用PGSK探针检测,通过流式细胞术或共聚焦显微镜监测活细胞内铁含量的细胞膜透性染料,结果表明,在铁死亡的细胞中,PGSK的绿色荧光会减弱;
(3)活性氧的水平:通过C11-BODIPY探针检测,在铁死亡细胞中,探针会由红色转化为绿色;
(4)QPCR/Western Blot:检测细胞内与铁死亡相关的因子的变化,例如COX-2,ACSL4,PTGS2,NOX1,GPX4和FTH1等,其中COX-2,ACSL4,PTGS2和NOX1在铁死亡细胞中表达上调;GPX4和FTH1在铁死亡细胞中表达下调。
2、形态观察
(1)透射电镜直接对细胞形态进行观察:细胞发生铁死亡时线粒体变小以及线粒体膜密度较大;
(2)线粒体膜电位检测:通过流式细胞仪收集TMRE阳性细胞的比例;
(3)线粒体形态观察:向细胞内转染LifeAct-GFP荧光蛋白,一定时间后通过有丝分裂追踪器观察线粒体的形态。







