近日,来自加州大学洛杉矶分校(UCLA)的周正洪教授等研究人员在《Nature》杂志上发表了题为“ A unified mechanism for intron and exon definition and back-splicing,”的论文,揭示了酵母剪接体E复合体的冷冻电镜结构,研究人员们根据这一结构提出的模型,可以将内含子识别、外显子识别、以及反向剪接(back-splicing)机制进行统一,对理解真核生物的pre-mRNA剪接有着重要意义。
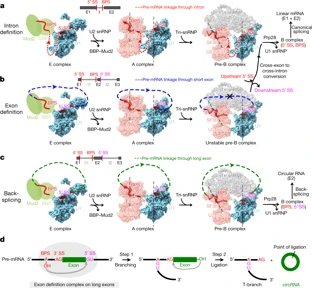
在经典的生物学理论中,DNA中的遗传信息会转录成为mRNA,再翻译成蛋白质。其中,pre-mRNA需要经历一个名为“剪接”的步骤,才能将其中的内含子去除,将外显子拼接在一起。这一关键步骤离不开剪接体(spliceosome)的参与。正确识别内含子(绿色)与外显子(黄色)是pre-mRNA正确剪接的第一步。
具体来看,剪接体在执行功能的过程中,会经历多个不同的复合体,其中第一个复合体也被称为是E复合体。在过去的几年里,在结构生物学家们的钻研与探索下,剪接体的其他复合体结构都得到了阐明,且让我们了解了关于剪接体运作的许多细节。然而,人们对于E复合体的结构还知之甚少。
(图1来源Nature)
在这项研究中,科学家们做出了突破。他们获得了酵母剪接体E复合体与ACT1 pre-mRNA或UBC4 pre-mRNA结合下的冷冻电镜结构。随后,他们通过生化实验,提出了一个简洁的模型,将内含子识别、外显子识别、以及反向剪接这三种过程进行了机制上的统一。
(评论:这种模型有望应用于所有的真核生物)
文章来源:
Xueni Li, Shiheng Liu, Lingdi Zhang, et al., (2019), A unified mechanism for intron and exon definition and back-splicing, Nature, DOI: https://doi.org/10.1038/s41586-019-1523-6 Published: 04 September 2019
2.Nature:在多种乳腺癌模型中,E-cadherin是转移所必需的
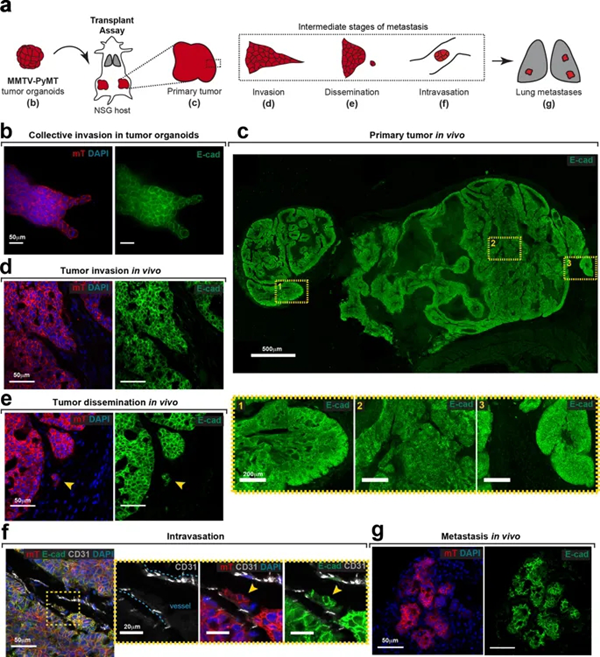
近日,来自美国知名的约翰霍普金斯大学等研究人员在《Nature》杂志上发表了题为“E-cadherin is required for metastasis in multiple models of breast cancer”的论文,主要是在人类癌细胞和小鼠模型中进一步探索了E-钙粘蛋白的功能。发现减少细胞里的这种蛋白,的确可以让肿瘤展现出疯狂的侵袭性。带有E-cadherin的肿瘤组织虽然会入侵周围,但速度并不算快。减少了E-cadherin后,肿瘤组织开始疯长,变得更有侵袭性。
癌细胞发生转移是癌症患者死亡的主要原因,癌细胞为什么会发生转移?这与一种叫做E-cadherin(E-钙粘蛋白)的蛋白质有关。从功能上看,它负责把不同的细胞“粘”在一起。如果癌细胞能够减少这种钙粘蛋白的表达,就会变得更有“活动性”,也更容易发生转移。
研究人员们在小鼠体内注射了癌细胞,想看看这些细胞会如何生长和转移。出乎他们预料的是,无论是最初形成的肿瘤,还是通过转移形成的肿瘤,甚至是正在血液里发生转移的癌细胞,许多细胞的E-钙粘蛋白并不少。
(图2来源Nature)
这项研究向我们揭示了E-钙粘蛋白的功能复杂性。在不同的情况下,它扮演了不同的角色。如果没有生存压力,癌细胞就会减少这种蛋白的表达,让自己更具侵袭性,从而促进癌细胞在局部疯狂生长。如果存在生存压力,癌细胞就会多表达这种蛋白,让自己活下去。
(评论:多了促进肿瘤转移,少了会让肿瘤疯长,这该如何治疗?)
文章来源:
Veena Padmanaban, Ilona Krol, Yasir Suhail,et al.E-cadherin is required for metastasis in multiple models of breast cancer.Nature (2019) | Published: 04 September 2019.
3.Nature:揭示了逃跑应激损害细胞防御系统并加速衰老的分子机制
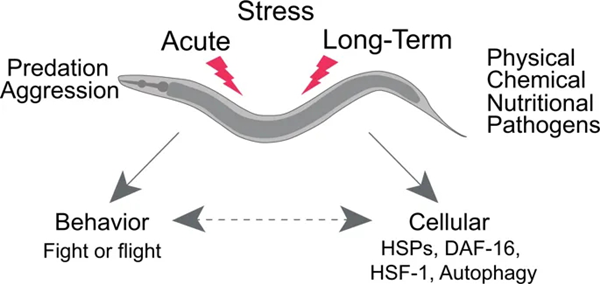
近日,来自美国麻省大学医学院的Mark J. Alkema等研究人员在《Nature》杂志上发表了题为“The flight response impairs cytoprotective mechanisms by activating the insulin pathway”的论文,研究人员以秀丽线虫为模型,发现反复诱导的逃跑应激反应通过激活胰岛素-IGF-1信号通路(IIS)并阻止相关应激反应基因的表达而抑制了保守的细胞保护机制,缩短了寿命,首次揭示了逃跑应激损害细胞防御系统并加速衰老的分子机制。
与其他动物一样,秀丽线虫的一生也面临着众多挑战,或是突发的(如捕食),或是逐步发生的(如氧化、高温或饥饿),秀丽线虫对于触摸的反应即是一种逃跑反应,在此过程中它会迅速地远离刺激。本文的研究人员发现,在线虫的整个生命周期中反复诱导触摸刺激的逃跑反应将明显缩短其寿命,而进一步的实验发现,逃跑反应的重复激活也降低了线虫对氧化应激或热应激的抵抗能力。
(图3来源Nature | 线虫面对不同的环境压力)
那么逃跑反应和环境应激对机体构成的这种相互矛盾的挑战到底是怎么产生的呢?
线虫的逃跑应激反应可以通过刺激触觉感受器神经元(TRN)来启动,而TRN可以反过来激活酪氨酸能RIM神经元,释放酪胺。酪胺,在结构与功能上与脊椎动物的肾上腺素和去甲肾上腺素类似,被认为在秀丽线虫逃跑反应的发生中起着至关重要的作用。本文研究发现,在逃跑反应和暴露于环境应激源时,RIM神经元表现出相反的活动模式,即在逃跑反应过程中,酪氨酸能RIM神经元的活性迅速增加,而暴露于环境应激源时,其活性下降。进而显示,逃跑应激反应过程中释放的酪胺虽然有利于线虫逃脱捕食等应激情况,但也削弱了线虫对随后环境应激的反应能力。
进一步实验发现,逃跑应激反应过程中RIM神经元释放的酪胺作为一种神经激素,通过激活线虫肠道中的TYRA-3受体来抑制环境应激反应,并且这种抑制作用依赖于DAF-2—IIS通路的激活,通过阻止DAF-16的入核来抑制应激反应基因的表达,从而抑制了保守的细胞保护机制。
(评论:逃跑反应损害细胞防御系统且加速衰老,也是有趣的发现。)
文章来源:
De Rosa MJ1, Veuthey T1, Florman J2, et al.The flight response impairs cytoprotective mechanisms by activating the insulin pathway.Nature. 2019 Aug 28. doi: 10.1038/s41586-019-1524-5. [Epub ahead of print]








