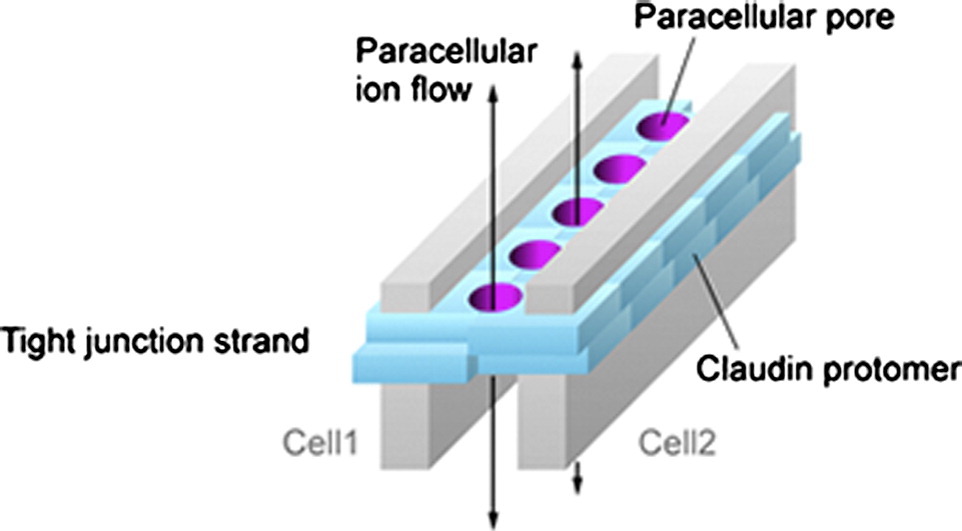
Claudins 是一个以组织或细胞特异性方式表达的小四体蛋白家族,是紧密连接多聚体蛋白结构的主要组成部分,可防止离子或小分子在上皮细胞或内皮细胞之间自由通过。这些蛋白质包含四个跨膜结构域,主要负责与相邻蛋白质并排相互作用。两个细胞外环调节细胞旁电荷选择性,并与存在于其他细胞表面的蛋白质形成非常紧密的复合物(反式相互作用或头对头相互作用),而胞质 C 末端尾部包含各种适合翻译后修饰的位点,以及一个蛋白质支架 PDZ 结构域。
 |
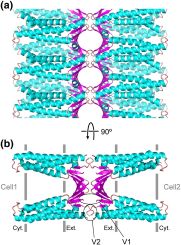 |
插图:Suzuki et al.分子生物学杂志 (2015) 427:291-297
亚型 Claudin-18.2已成为胃癌、食管癌和胰腺癌中一个有前途的治疗靶点。
基因组学
CLDN18 基因位于染色体区域 3q22.3 上,编码 261 个氨基酸的两种亚型 (亚型 1 和 2 分别为 NM_016369.3 和 NM_001002026.2)。Claudin-18 是该家族中为数不多的对细胞谱系表现出严格限制的成员之一,这一特性在哺乳动物中是保守的。因此,claudin-18.1 仅限于肺的肺泡上皮细胞,而 claudin-18.2 仅在胃粘膜的分化细胞中表达。
CLDN18 在物种间表现出高序列同源性,包括在启动子区域内 (1)。人 CLDN18 基因包含 6 个外显子和 5 个内含子,具有两个启动子 P1 和 P2,每个启动子都控制自己的第一个外显子。这些启动子的替代使用导致分别产生肺和胃特异性转录本 18.1 和 18.2。此外,claudin-18 转录本包含一个替代的 12 个碱基对插入,其中包含一个朝向外显子 4 5' 末端的终止密码子 TGA,这可能会产生截短的剪接变体,可能导致 mRNA 衰变加速。
每种亚型的第一个细胞外环中关键氨基酸的差异赋予特定功能。例如,claudin-18.2 对钠和质子具有选择性密封功能,但对氯化物没有选择性密封功能 (2)。
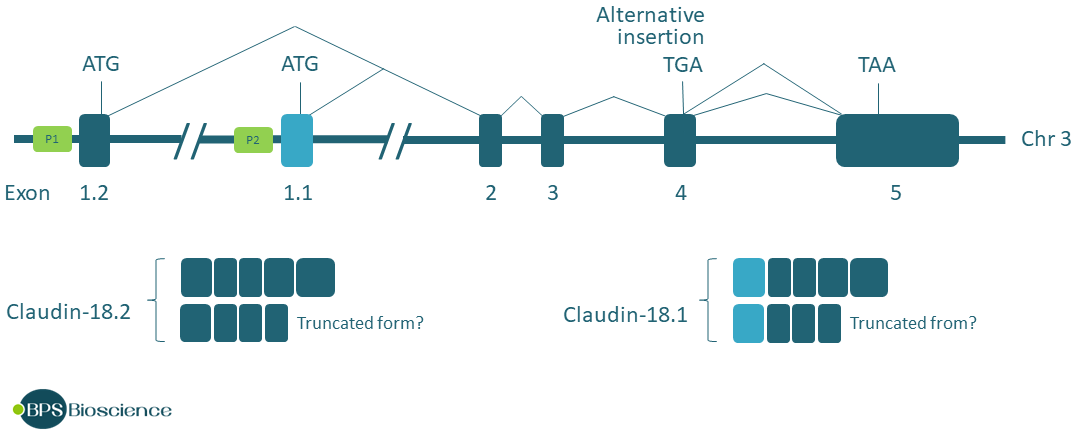
基于 CLDN18 基因组结构的插图
下游启动子 P2 包含转录因子 T/EBP/NKX2.1 的结合位点,该转录因子参与肺胚胎发育,仅限于肺泡型 II (AT2) 和 Clara 细胞。T/EBP/NKX2.1 负责 claudin-18.1 在肺泡上皮中的选择性表达,有趣的是,它不会诱导任何其他 claudin 基因 (3)。用于产生 claudin-18.2 的上游启动子 P1 受转录因子环状 AMP 反应元件结合蛋白 (CREB) 的调节。
Claudin-18 限制性表达模式使其成为如此有吸引力的癌症靶点,因为它会降低靶向异位效应的可能性。
功能
紧密连接 claudins 调节细胞间隙的通透性以及水、特定离子和大分子的循环。此外,它们参与细胞间粘附,有助于维持紧密的上皮或内皮。Claudins 不仅与相邻细胞上的其他蛋白质相互作用,而且还通过其细胞质 PDZ 结构域与细胞骨架蛋白和细胞信号转导蛋白结合和合作,充当信号转导枢纽。Claudin-18 通常通过收紧不依赖钙的细胞间粘附来消除细胞间隙。CLDN18.2 在胃粘膜的上皮细胞中表达,控制细胞旁对 H+ 和 Na + 的通透性。
从已生成的两种 claudin-18 缺陷小鼠模型中观察到,claudin-18.1 对出生后肺发育和细胞结构的维持很重要 (2)。形态学异常表明 claudin-18.1 调节肺泡形成,并表明可能在肺纤维化或慢性阻塞性肺疾病 (COPD) 中发挥作用,其中肺泡形态被破坏。转基因小鼠在屏障功能方面表现出令人惊讶的温和表型,即使在对损伤的反应中也是如此,显示出几乎正常的体液平衡。除了维持细胞旁屏障的选择性通透性外,claudin-18 似乎还控制细胞表型和炎症,正如观察到促炎细胞因子 IL-1β 的血浆水平在 claudin-18 缺陷小鼠中显著增加所表明的那样 (2)。
有趣的是,基因敲除小鼠的肺出乎意料地大,这揭示了 claudin-18.1 在调节 2 型肺泡上皮 (AT2) 细胞增殖中的作用,至少部分是由转位到转录调节因子 Yes 相关蛋白 (YAP) 的细胞核驱动的。这具有重要的病理学意义,因为与正常小鼠相比,CLDN18 缺陷小鼠的肺腺癌发生率也增加 (4)。基因敲除小鼠的胃和肾脏也意外增大,尽管这在小鼠中没有观察到,其中仅针对 claudin-18.2,可能是由于挽救作用。Claudin-18 敲除小鼠最终会在肺癌和胃癌中发展。
因此,claudin-18 的正常功能似乎通过调节细胞稳态以及控制细胞粘附和增殖来抑制肿瘤。有人提出,上皮细胞紧密连接结构的改变对形态、细胞迁移和转移都有影响。
CLDN18 的遗传改变
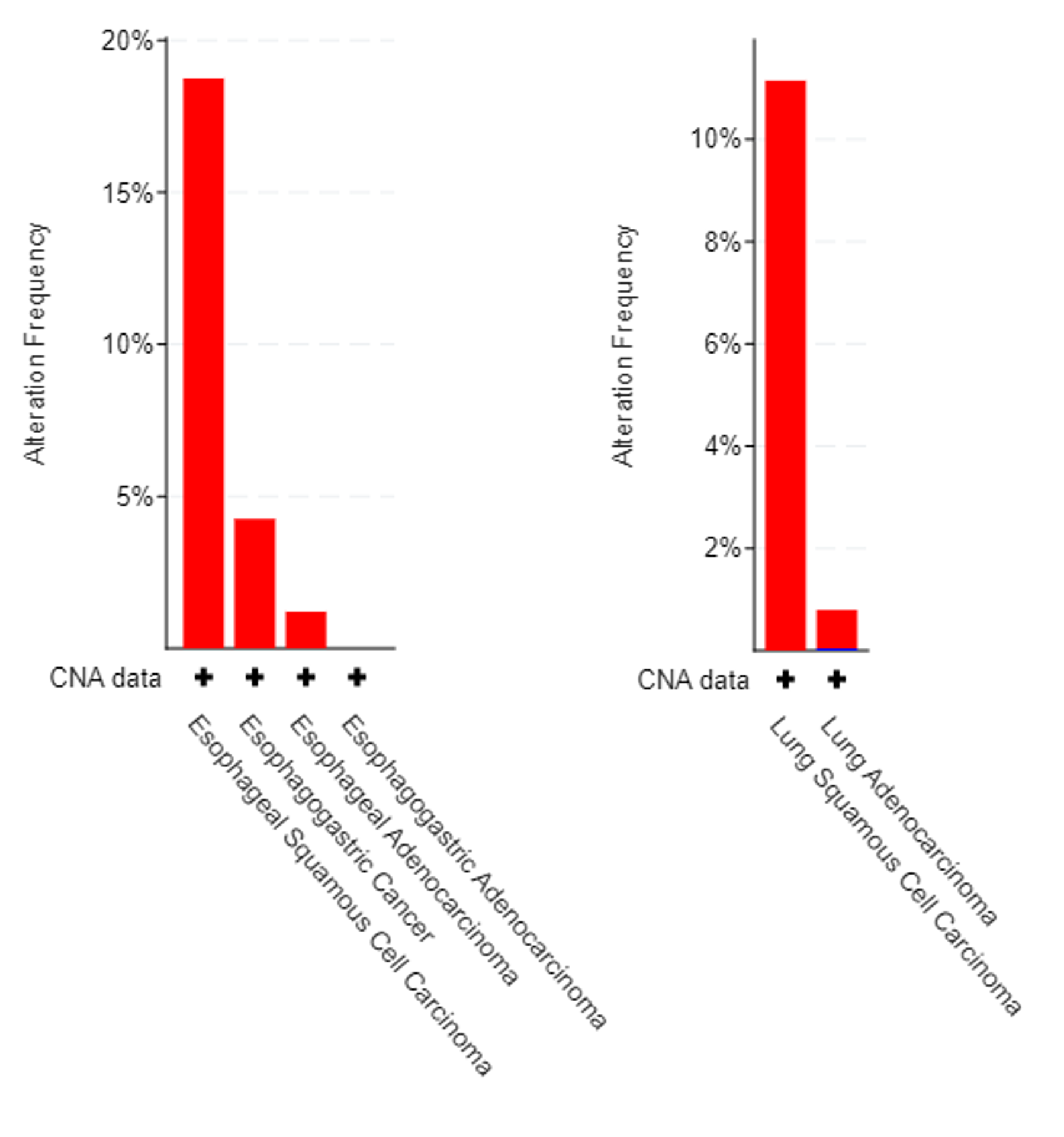
CLDN 突变在癌组织中非常罕见,尚未发现该基因家族的驱动突变。另一方面,据观察,CLDN18 基因扩增在鳞状细胞癌(一种癌症的组织学亚型)中以相对较高的频率发生:超过 15% 的食管鳞状细胞癌样本和超过 10% 的肺鳞状细胞癌样本显示 CLDN18 扩增(图 3)。
CLDN18 基因在食管癌(左)和肺癌(右)中的扩增。食管癌数据对应于 4 项包含 CNA 数据的研究中来自 503 名患者的 1191 份肿瘤样本。肺癌数据对应于包含 CNA 数据的数据集的 10 项研究中来自 7970 名患者的 9788 个肿瘤样本。数据分析来自 Cancer Genome Atlas
在胃腺癌的分子表征中,癌症基因组图谱研究网络揭示了 CLDN18-ARHGAP26 易位,通常存在于 15% 的基因组稳定组(胃癌的四种亚型之一)中。这是通过外显子 5 后 CLDN18 的基因组重排以及与 ARHGAP26 的外显子 2、10 或 12 融合来实现的 (5)。尽管融合发生在 CLDN18 终止密码子的下游,但会产生成熟的 mRNA 转录本。在 CLDN18 外显子 5 中使用隐蔽剪接位点可产生一种框内融合蛋白,预计包含 CLDN18 的跨膜和 C 端结构域。C 端结构域与 ARHGAP26 的 GAP 结构域融合,可能会影响小蛋白 RhoA 的活性,从而调节细胞粘附和运动,从而可能导致侵袭性表型。与未进行融合的患者相比,具有这种基因融合的患者生存结果较差,并且对化疗的耐药性增加。
由 claudin-18.2 外显子 5 和 ARHGAP26 外显子 12 融合产生的新蛋白的图示。
癌症中表达的失调
癌变引起的异常细胞信号转导可能通过多种机制导致密蛋白表达或功能改变,使紧密连接松动,并导致组织形态改变、去分化、迁移和转移。例如,在胃癌细胞中,claudin-18.2 的下调可能有助于肿瘤细胞增殖和趋化性。
mRNA
在几种类型的癌症中,在 mRNA 水平或蛋白质水平上观察到 claudin-18 表达的改变 (6, 7),但 mRNA 表达模式并不总是与在人体组织中观察到的蛋白质表达模式相关。此外,肿瘤组织异质性意味着同一肿瘤的两个区域之间的表达可能不同 (8)。然而,目前的共识是,与 claudin-18.1 表达高的正常组织相比,claudin-18.1 的 mRNA 表达在肺癌组织中非常低甚至不存在,这与肿瘤抑制功能一致。与正常组织相比,胃/食管癌组织中 claudin-18.2 mRNA 的表达水平低约 60%,可能与胃肿瘤样本基因组中高甲基化模式的增加有关。有趣的是,虽然 claudin-18.2 通常不存在于胰腺中,但它在胰腺癌细胞中上调 (6)。
蛋白
在蛋白质水平上,在胃癌、食管癌或胰腺癌患者获得的人体组织标本中始终观察到强抗体染色。根据研究结果,claudin-18.2 在所有胃癌和胰腺癌组织样本的 20% 至 80% 中强强表达 (8-11)。所有研究均发现,转移病灶中 claudin-18.2 的表达水平与相应原发癌组织中的表达水平一致,这是靶向治疗的临床重要考虑因素,因为大多数患者死于转移。有趣的是,常见的胃癌细胞系,如 293T、AGS 和 BGC-823,可能根本不表达 claudin-18.2 (10)。
claudin-18.2 在约 50% 的胰腺癌中异常表达,但在正常组织中没有,为这种难以治疗的癌症创造了独特的治疗机会 (11, 12)。事实上,临床前研究表明,抗 claudin-18.2 抗体在体内抑制患者来源的胰腺异种移植肿瘤 [Zhu 2019]。
患者来源的胃和胰腺肿瘤,用抗 CLDN18.2 抗体染色(左),以及用抗人细胞角蛋白的抗体(中)和 E-钙粘蛋白(右)。原文转载自 (8)
上皮-间充质转化
Claudin-18.2 蛋白表达与上皮-间质转化 (EMT) 的程度或干性呈负相关。因此,胃腺的干细胞区不存在该蛋白质,并且密蛋白 18.2 的表达在这些干细胞起源的肿瘤中较低。相反,claudin-18.2 表达在分化的胃细胞中升高,当细胞转变为未分化状态或通过 EMT 转化进展时降低 (13)。
由于 EMT 导致组织上皮组织的缺失和细胞间连接的紊乱,因此 claudin-18.2 变得离位。claudin-18.2 在顶端紧密连接中的正确定位使其几乎无法被抗体接近,而蛋白质的细胞外结构域在肿瘤组织中变得可接近,这主要显示缺乏极性的杂乱无章的肿瘤细胞。就其本身而言,这种现象极大地促进了 claudin-18.2 作为治疗靶点的吸引力。
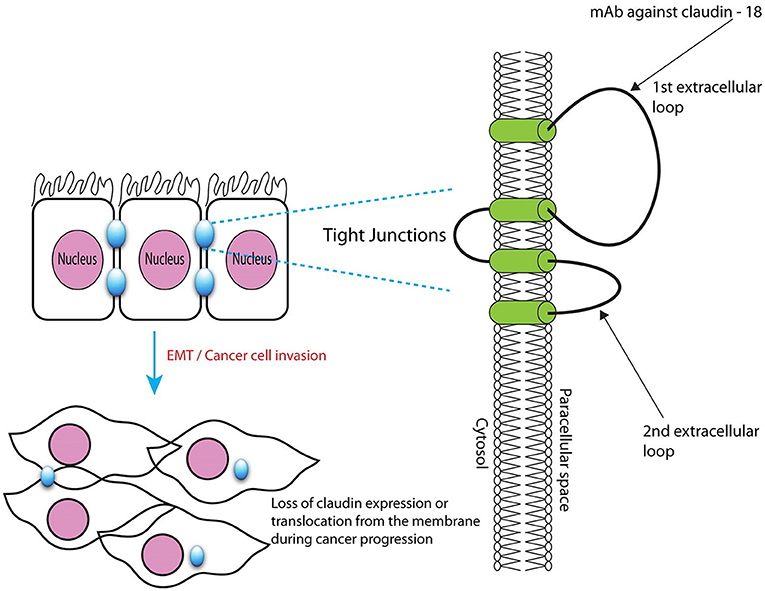
插图:Kumar V. 等人,2018 年,doi.org/10.3389/fphar.2018.00404,CCBY 4.0
生物标志物和分子成像
claudin-18 抗体染色增强和胃癌或胰腺腺癌中表达的高选择性表明,该蛋白质可用作伴随诊断的生物标志物,以选择最有可能从基于抗体的治疗策略中受益的患者。此外,标记抗体可与正电子发射断层扫描 (PET) 结合使用,以在手术前描绘肿瘤边界并指导手术切除 (14)。
治疗机会
由于其在胃癌、食管癌和胰腺癌(包括转移灶)中的表达受限,claudin-18.2 是治疗这些类型癌症的非常有前途的治疗靶点。在肿瘤进展过程中,蛋白质细胞外结构域对抗体的暴露增加,使其成为基于抗体的方法的理想选择。
晚期胃食管 (GE) 腺癌和胰腺癌患者的 5 年生存率分别为 5-20% 和 6-8%。晚期胰腺癌患者的中位总生存期约为 3.5 个月,GE 癌患者的中位总生存期约为 10 个月,因此迫切需要新的治疗方式。这些肿瘤中约有 30% 过表达 claudin-18.2,为目前没有很多 claudin-18.2 的患者提供了新的选择。
理想情况下,治疗剂最好与癌细胞结合,而不是与正常组织结合。仅在癌细胞中存在或可接近的靶标(例如 claudin-18.2)具有吸引力,因为靶标副作用减少,提供了更广阔的治疗窗口。然而,亚型 18.1 与 18.2 仅不同 7 个氨基酸(位于第一个细胞外环 ECL1),这是开发针对 claudin-18.2 的高选择性抗体的障碍。尽管如此,现在正在开发各种治疗策略,以利用 claudin-18.2 在癌细胞中的差异可及性。这些策略包括单克隆抗体、用于细胞过继转移的 claudin 定向嵌合抗原受体 (CAR)、抗 claudin-18.2/PD-L1 双特异性抗体、抗 claudin/抗 CD3 双特异性 T 细胞接合器和四价接合器,以及抗体药物偶联物 (7, 15)。
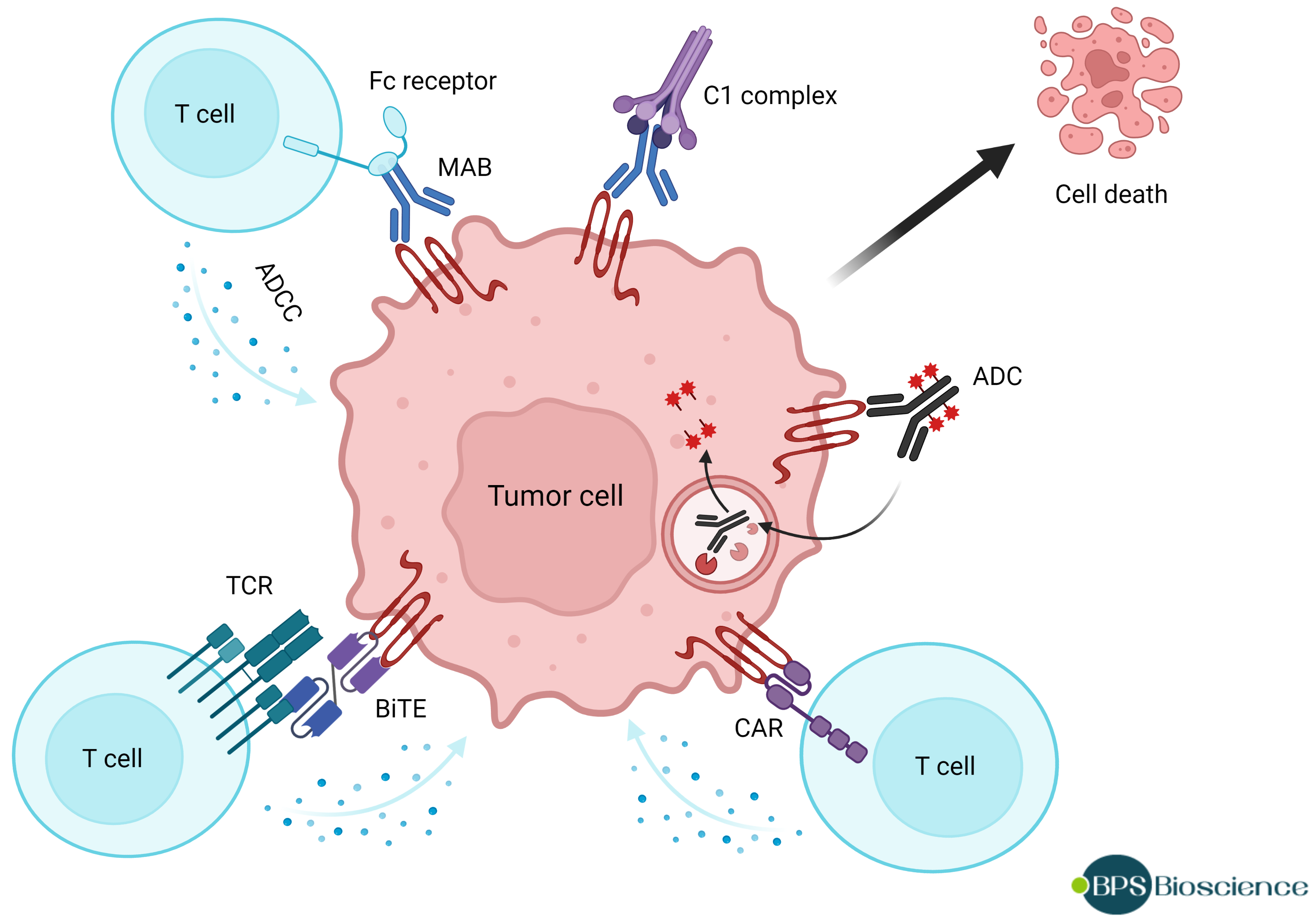
针对 claudin-18.2 的各种治疗策略的插图。ADC: 抗体-药物偶联物;ADCC: 抗体依赖性细胞毒性;BiTE: 双特异性 T 细胞接合器;CAR: 嵌合抗原受体;MAB: 单克隆抗体;TCR:T 细胞受体。
第一个建立概念验证并进入后期临床试验的 claudin 定向治疗性抗体是 Zolbetuximab,也称为 IMAB362 和 claudiximab,由 Ganymed Pharmaceuticals AG 开发,用于治疗 claudin-18.2 阳性胃癌、食管癌和胰腺癌。该抗体是一种针对细胞外环 claudin-18.2 的人源化嵌合 IgG1 单克隆抗体,对 claudin-18.2 具有高度特异性,并且不识别 claudin-18.1。与正常组织相比,IMAB362显示出非常好的肿瘤选择性,并且在临床前研究中,它在 CLDN18.2+ 人异种移植物中诱导细胞死亡。
从机制上讲,IMAB362 通过抗体依赖性细胞毒性 (ADCC) 和补体依赖性细胞毒性参与免疫系统来介导细胞死亡 (16)。FAST 试验中证明了胃和胃食管交界处 (GEJ) 癌的临床疗效,其中包括提高总生存期,验证了 claudin-18.2 作为治疗靶点,并为抗 claudin-18.2 抗体的使用和进一步开发铺平了道路。
疗效与 >70% 细胞中的高 claudin-18 表达相关,提供预后标志物和临界点 (13)。抗体与化疗的联合治疗有望增加 ADCC,事实上,与单独化疗相比,该抗体在晚期密蛋白 18.2 阳性胃癌和胃食管癌中显示出生存获益。该抗体目前正在研究胃肠道腺癌和胰腺肿瘤。
2) 抗体-药物偶联物
靶向 claudin-18.2 的前两种抗体药物偶联物 (ADC) 是 Conjupro Biotherapeutics 开发的 CPO102 和来自 SOTIO 和 NBE Therapeutics 的 SOT102。CPO102 是一种与单甲基 auristatin E (MMAE) 偶联物偶联的抗 claudin-18.2 单克隆抗体。MMAE,也称为 vedotin,是一种抗有丝分裂剂,其效力约为阿霉素的 100-1000 倍,通过阻断微管蛋白聚合发挥作用。MMAE 非常有效,以至于它本身不能用作药物,但它经常用作 ADC 中的有效载荷,因为抗体限制了药物在体内的分布,从而大大降低了全身毒性。
药物偶联抗体的不同之处在于构建体中使用的特异性抗体部分、附加的药物分子数量、接头的化学性质和大小以及接头设计固有的激活机制。因此,CPO102 使用接头与 MMAE 偶联,该接头在血浆和细胞外环境中稳定,但一旦 ADC 找到其靶标并进入肿瘤细胞,就会被组织蛋白酶裂解,然后 MMAE 从抗体中释放出来。另一方面,SOT102 使用 sortase 介导的抗体偶联以位点特异性方式进行偶联。不可裂解的酰胺/肽接头用于连接 PNU159682 的衍生物, 是蒽环类药物 nemorubicin 的高效代谢物,可作为 DNA 拓扑异构酶 II 抑制剂。抗 claudin-18.2 抗体的效应功能已被修饰,以减少 FcRγ 相互作用,同时保持 FcRn 结合。
3) 双特异性抗体
抗 CD3 双特异性抗体由两种独立的抗体构成,一种与肿瘤细胞上的靶蛋白结合,另一种与表面 T 细胞上 T 细胞受体 (TCR) 的 CD3 亚基结合。因此,这些抗体用于将免疫细胞重定向到肿瘤并诱导 T 细胞介导的细胞毒性。
在他们的概念验证研究中,Zhu 等人报道了人源化 CD3ε x claudin-18.2 双特异性抗体和由人 IgG2 Fc 片段组成的双抗体的设计,该抗体具有减少 Fcγ 受体结合的突变。这些抗体在胃癌和胰腺癌的细胞模型中诱导了类似的细胞毒性。两种构建体都抑制了植入免疫功能低下 NSG 小鼠体内的胃患者来源的异种移植肿瘤的生长,尽管与双特异性抗体相比,该抗体具有更好的体内疗效 (8)。
4) CAR T 细胞
第一个进入临床的 claudin-18 导向自体 CAR-T 细胞疗法是 CT041,由 CARsgen Therapeutics, Ltd. 开发。CARsgen 的科学家开发了一种对 claudin-18.2 亚型具有特异性的人源化单克隆抗体,并使用单链片段变量 (scFv) 构建 CAR,CAR 通过慢病毒感染转导到 T 细胞中。对携带胃癌患者来源的肿瘤异种移植物的小鼠的体内评估显示,即使在正常胃组织中,肿瘤也部分或完全消除,没有明显的毒性 (10)。
CT041 正在美国和中国进行临床试验,胃癌占全球病例总数的 40% 以上。对极晚期疾病患者的初步结果表明,总体缓解率为 60%,高于历史数据预测,这预示着抗密蛋白 18.2 CAR-T 细胞疗法的未来。
结论
凭借可喜的临床试验结果和正在开发的各种治疗方法,claudin-18 定向疗法的前景一片光明。到目前为止,靶向 claudin-18 的副作用似乎相对较轻,这将进一步激励药物开发工作。胰腺癌的临床试验正在进行中,为这种难以治疗的癌症带来了一线希望。
引文
(1) Türeci O, et al. Claudin-18 gene structure, regulation, and expression is evolutionary conserved in mammals. Gene (2011) 481(2): 83-92. PMID: 21571049.
(2) Schlingmann B, et al. Claudins: Gatekeepers of lung epithelial function. Semin Cell Dev Biol. (2015) 42: 47-57. PMID: 25951797.
(3) Niimi T, et al. Claudin-18, a novel downstream target gene for the T/EBP/NKX2.1 homeodomain transcription factor, encodes lung- and stomach-specific isoforms through alternative splicing. Mol Cell Biol. (2001) 21(21): 7380-90. PMID: 11585919.
(4) Zhou B, et al. Claudin-18-mediated YAP activity regulates lung stem and progenitor cell homeostasis and tumorigenesis. J Clin Invest. (2018) 128(3): 970-984. PMID: 29400695.
(5) Cancer Genome Atlas Research Network. Comprehensive molecular characterization of gastric adenocarcinoma. Nature. (2014) 513(7517): 202-9. PMID: 25079317.
(6) Li J. Dysregulated expression of claudins in cancer. Oncol Lett. (2021) 22(3): 641. PMID: 34386063.
(7) Kyuno D, et al. Claudin-18.2 as a therapeutic target in cancers: cumulative findings from basic research and clinical trials. Tissue Barriers. (2022) 10(1): 1967080. PMID: 34486479.
(8) Zhu GF, et al. Targeting CLDN18.2 by CD3 Bispecific and ADC Modalities for the Treatments of Gastric and Pancreatic Cancer. Sci Rep. (2019) 9(1): 8420. PMID: 31182754.
(9) Mitnacht-Kraus R, et al. Preclinical characterization of IMAB362 for the treatment of gastric carcinoma. Abstracts developmental therapeutics (2017) 28(S5): V126; Open Archive.
(10) Jiang H, et al. Claudin18.2-Specific Chimeric Antigen Receptor Engineered T Cells for the Treatment of Gastric Cancer. J Natl Cancer Inst. (2019) 111(4): 409-418. PMID: 30203099.
(11) Tanaka M, et al. Claudin-18 is an early-stage marker of pancreatic carcinogenesis. J Histochem Cytochem. (2011) 59(10): 942-952. PMID: 21832145.
(12) Li J, et al. Analysis of the expression and genetic alteration of CLDN18 in gastric cancer. Aging (Albany NY). (2020) 12(14): 14271-14284. PMID: 32668412.
(13) Sahin U, et al. FAST: a randomised phase II study of zolbetuximab (IMAB362) plus EOX versus EOX alone for first-line treatment of advanced CLDN18.2-positive gastric and gastro-oesophageal adenocarcinoma. Ann Oncol. (2021) 32: 609-619. PMID: 33610734.
(14) Cao W, et al. Claudin18.2 is a novel molecular biomarker for tumor-targeted immunotherapy. Biomark Res. (2022) 10(1): 38. PMID: 35642043.
(15) Zhang J, et al. Evaluation and reflection on claudin 18.2 targeting therapy in advanced gastric cancer. Chin J Cancer Res. (2020) 32(2): 263-270. PMID: 32410803.
(16) Türeci Ӧ, et al. Characterization of zolbetuximab in pancreatic cancer models. Oncoimmunology (2018) 8(1): e1523096. PMID: 30546962.