"细胞-细胞间交互"近年一直是高分文章大受关注领域,以外泌体(或者胞外囊泡)及其成分(如RNA、脂质和蛋白)、线粒体转移(比如隧道纳米管介导的)、配体-受体(比如膜配体、分泌性配体以及膜受体)为代表,倘若你同样怀有这份兴趣,那该怎样着手深入研究呢?今天,我打算重点这三种作用方式的研究方法。
一、外泌体介导的细胞间通讯
外泌体是细胞分泌的纳米级囊泡,携带蛋白质、RNA等生物分子,通过与受体细胞融合或被内吞,传递信号调节其功能。
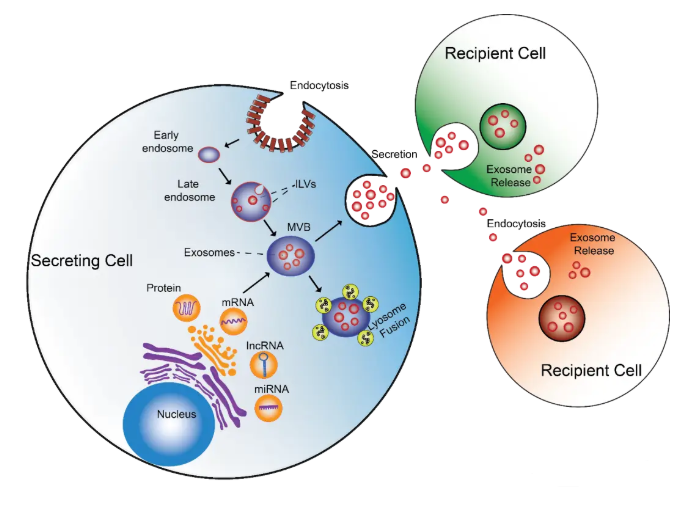
外泌体的生物发生、降解和分泌
研究方法:
1)外泌体分离、鉴定和表征方法
外泌体分离常用差速超速离心、密度梯度超速离心、过滤、超滤等传统方法,也可用微珠、微流控芯片等新技术。鉴定时需检测外泌体的蛋白标志物,如CD9、CD63、CD81等,常用Western blot。表征包括形态和粒径分布,可使用透射电子显微镜(TEM)、纳米颗粒跟踪分析(NTA)等。
2)外泌体示踪细胞间传递方法
示踪方法包括荧光染料标记,如PKH26、PKH67等,可直接与外泌体脂质双层膜结合;核酸标记,将外泌体核酸标记为荧光或放射性探针;蛋白质标记,用GFP等标记外泌体表面蛋白;还可利用磁性纳米颗粒标记,通过磁共振成像追踪。
3)外泌体成分的组学分析
外泌体组学分析主要包括蛋白质组学、转录组学和脂质组学。蛋白质组学通过质谱技术分析外泌体中的蛋白质组成;转录组学利用高通量测序技术研究外泌体中的RNA种类和表达水平;脂质组学采用质谱技术分析外泌体中的脂质组成。
4)外泌体与受体细胞共培养方法
将提取纯化的外泌体加入受体细胞培养液中,通过观察受体细胞的反应和表型来研究外泌体对受体细胞的影响。此外,也可标记外泌体后进行共培养,实时监测其在受体细胞中的动态变化。
二、线粒体转移
粒体可通过隧道纳米管(TNTs)、细胞外囊泡或直接细胞外释放等方式从一个细胞转移到另一个细胞,支持受体细胞的代谢需求。
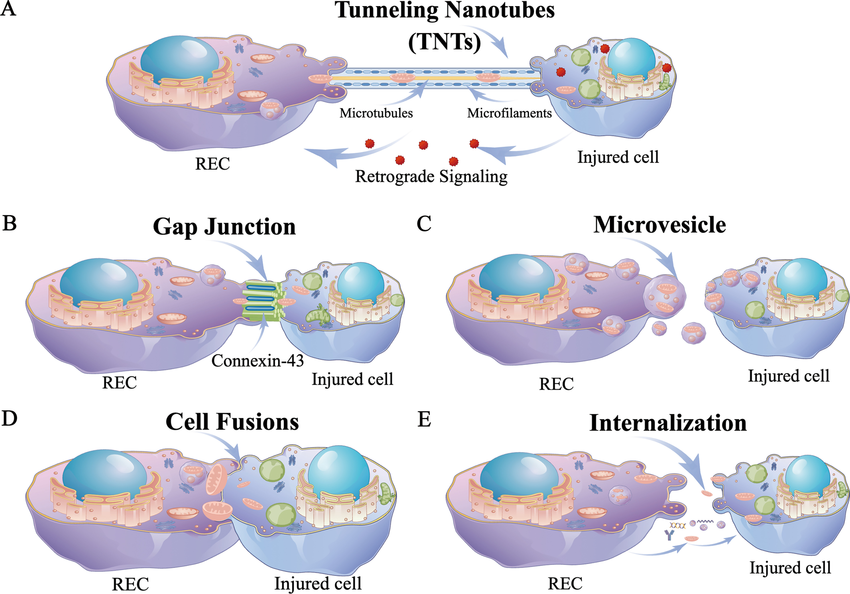
线粒体从 REC 转移到受体细胞的路线
研究方法:
1)线粒体分离和鉴定
线粒体分离通常采用差速离心法,先低速离心去除细胞碎片和核,再高速离心沉淀线粒体。鉴定方法包括透射电子显微镜(TEM)观察其双层膜结构,以及通过特异性抗体(如抗TOM20抗体)进行Western blot检测。
2)分离线粒体后与细胞共培养
将分离的线粒体加入受体细胞培养液中,通过荧光显微镜或流式细胞术观察线粒体是否被摄取。也可利用化学诱导供体细胞线粒体耗竭后与受体细胞共培养,比较处理前后受体细胞的差异。
3)细胞共培养体系下的线粒体标记和示踪
使用荧光染料(如MitoTracker)或荧光蛋白(如GFP)标记供体细胞的线粒体,然后与受体细胞共培养。通过荧光显微镜或共聚焦显微镜观察线粒体在受体细胞中的分布,从而示踪线粒体转移。
4)单细胞测序结合MERCI分析
获取共培养的癌细胞和T细胞的转录组数据后,应用MERCI算法识别线粒体突变(mtSNVs)并估计癌细胞中外源线粒体的相对丰度。通过比较突变频率,确定T细胞特有的突变,将细胞分类为潜在的线粒体供体和受体。并通过计算DNA和RNA排名分数,预测线粒体的受体细胞和供体细胞。
三、配体-受体结合
配体与受体结合后,诱导受体构象变化,激活下游信号通路,调节细胞功能。

研究方法:
1)阻断性抗体阻断受体活化
使用针对受体特定区域的阻断性抗体,该抗体可特异性结合受体,阻止配体与受体结合,从而抑制受体的活化。通过检测下游信号通路的激活情况(如蛋白磷酸化水平),评估阻断效果,用于研究受体活化的功能和信号传导机制。
2)中和性抗体降低配体浓度
利用中和性抗体与配体特异性结合,形成抗体-配体复合物,从而降低游离配体的浓度。通过检测细胞对配体的反应(如细胞增殖、细胞因子分泌等),评估中和效果,用于研究配体在生理过程中的作用和调控机制。
3)配体-与受体在组织与细胞共培养体系下的染色与共定位
在共培养体系中,分别用荧光标记的抗体对配体和受体进行染色。通过荧光显微镜或共聚焦显微镜观察两者的荧光信号,分析其共定位情况。共定位分析可借助软件计算共定位系数,判断配体与受体是否在同一细胞区域聚集,从而推断二者在生理条件下的相互作用。
4)免疫共沉淀验证配体-与受体结合
将细胞裂解后,加入针对受体的特异性抗体,孵育使抗体与受体结合。再加入蛋白A/G琼脂糖珠,通过抗体与珠子结合沉淀受体蛋白复合物。最后通过Western blot检测沉淀物中是否存在配体蛋白,若检测到配体,则说明二者在细胞中存在结合。
5)表面等离子共振检测配体-受体结合强度
将受体固定在SPR芯片表面,配体在流动相中通过芯片表面。SPR技术可实时监测配体与受体结合过程中的折射率变化,从而获得结合亲和力(KD)、结合速率常数(ka)和解离速率常数(kd)等动力学参数,用于定量分析二者的结合强度。
6)分析配体与受体结合后受体构象改变







