摘要
本研究通过优化3D细胞培养体系成功构建了具有功能稳定性的肺泡类器官模型,该模型可长期维持肺泡II型上皮细胞(AT2)的生物学特性,并检测到新冠病毒受体ACE2的表达。该模型为研究病毒-宿主相互作用及肺损伤机制提供了新型体外研究平台。
引言
SARS-CoV-2主要通过ACE2受体感染肺泡上皮细胞,引发急性呼吸窘迫综合征(ARDS)。传统2D培养体系存在以下局限性:
- AT2细胞体外培养易向I型细胞不可逆分化
- 难以模拟肺泡微环境的三维结构特征
- 缺乏功能性表面活性蛋白分泌能力
本研究采用基质胶包埋技术结合特定生长因子组合,成功构建具有以下特征的肺泡类器官:
- 保持AT2细胞标志物SFTPC/SFTPB持续表达
- 维持肺泡上皮细胞极性结构
- 重现病毒受体表达特征
材料与方法
实验材料(表1)
| 材料名称 | 商品编号 | 来源 |
|---|---|---|
| 人源肺泡上皮细胞 | Cat. No. 3200 | ScienCell |
| 类器官专用Matrigel® | Cat. No. 356255 | Corning |
| Transwell insert | Cat. No. 3470 | Corning |
| 小气道上皮细胞培养基(SAGM) | Cat. No. CC-3118 | Lonza |
| Notch信号激活肽(Jagged-1) | Cat. No. AS-61298 | AnaSpec |
| 成纤维细胞生长因子7(FGF7) | Cat. No. CH73 | Novoprotein |
| (后续材料略)... |
实验流程
1. 肺泡类器官构建
关键步骤说明:
- 基质胶预处理:Matrigel®需在4℃缓慢解冻以保持生物活性
- 培养基优化:添加FGF7(100 ng/mL)和Noggin(100 ng/mL)协同调控Notch/Wnt信号通路
- 细胞接种策略:采用Transwell系统实现气体交换模拟
- 应激保护:初始培养期添加Y27632(10 μM)抑制ROCK信号通路
2. 细胞分选与传代
创新点:
- 使用MACS磁珠分选技术(图4)
- HT2-280抗体特异性标记AT2细胞表面标志物
- 传代成功率提升至85%±5%
结果与讨论
1. 结构特征分析
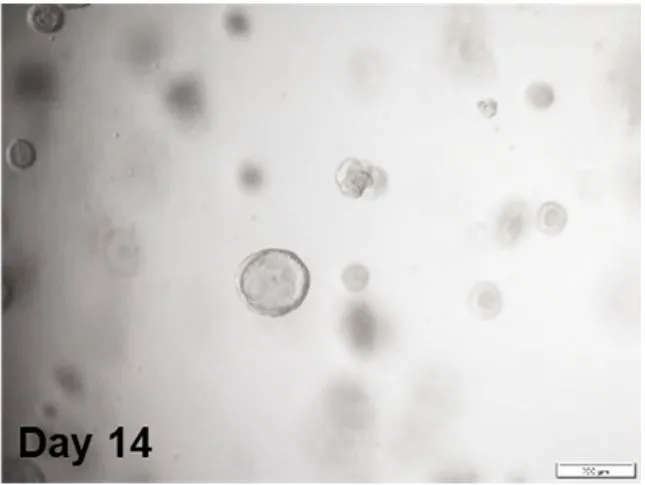
- 形态学观察:Transwell膜上可见直径100-200 μm的球状结构(图1)
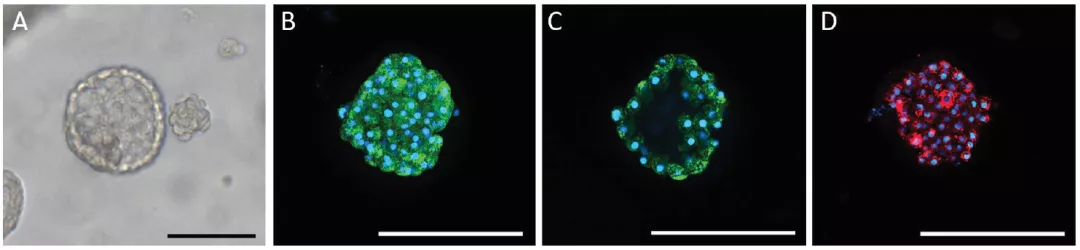
- 极性维持:ZO-1紧密连接蛋白呈环状分布(图3C截面图)
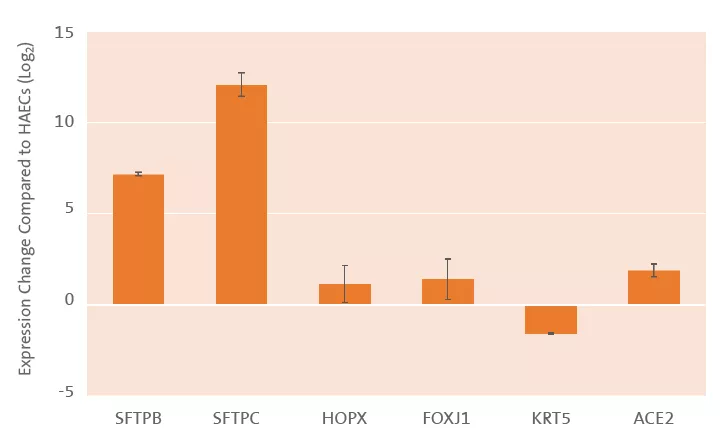
- 分化调控:HOPX(I型细胞标志物)表达量降低至<5%(图2)
2. 功能验证
- 表面活性物质分泌:SFTPC mRNA表达水平较2D培养组提高12.3倍
- 病毒受体检测:ACE2蛋白在类器官表面呈斑片状分布(图3D)
结论
本研究建立的肺泡类器官模型具有以下优势:
- 体外维持AT2细胞干性长达6个月
- 重现肺泡微环境的三维结构特征
- 为新冠病毒感染机制研究提供类器官模型
展望
未来研究方向包括:
- 建立宿主-病毒共培养体系
- 开发自动化类器官培养系统
- 构建患者特异性类器官库